Position Statement GIMBE
Evidence 2017;9(3): e1000163 doi: 10.4470/E1000163
Pubblicato: 27 marzo 2017
Copyright: © 2017 Cartabellotta et al. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente lâutilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
I tumori rappresentano un gruppo molto eterogeneo di malattie che possono colpire qualsiasi parte del corpo e si presentano con numerose varianti anatomiche e molecolari, ciascuna dei quali richiede specifiche strategie diagnostico-terapeutiche. Lâimpatto delle neoplasie sui sistemi sanitari è enorme, sia in termini epidemiologici ed economici, sia per le modalità con cui la malattia incide sul paziente e i suoi familiari. I tumori ogni anno causano nel mondo 8,8 milioni di morti, ovvero 1 decesso su 6 è conseguente a patologie neoplastiche (1). In Italia nel 2016 sono stati diagnosticati oltre 365.000 nuovi casi di tumore maligno ed erano oltre 3,1 milioni le persone viventi con diagnosi di tumore (2). I dati dellâISTAT indicano per il 2014 (ultimo anno disponibile) che i tumori sono la seconda causa di morte (29,6% di tutti i decessi) dopo le malattie cardiovascolari (36,8%): in particolare, oltre 177.000 decessi attribuibili a tumore tra i quasi 600.000 del 2014 (3).
Dal punto di vista delle politiche sanitarie e della conseguente organizzazione dei servizi, lâOrganizzazione Mondiale della Sanità (OMS) raccomanda la strategia del comprehensive cancer control (4), costituita da vari interventi sanitari: prevenzione primaria, screening e diagnosi precoce, trattamento, cure palliative e assistenza ai sopravviventi. Secondo lâOMS ogni paese dovrebbe definire un piano nazionale di controllo dei tumori (5) — National Cancer Control Plan (NCCP) — basato su unâassistenza sanitaria integrata e centrata sulla persona e rigorosamente monitorato (6).
In Italia, come primo tentativo di NCCP, il Ministero della Salute ha messo a punto il Piano Oncologico Nazionale 2010-2012, per « programmare in modo adeguato lo sviluppo tecnologico e lâallocazione delle risorse disponibili nel settore oncologico al fine di garantire a tutti i pazienti lâaccesso alla migliore assistenza » (7). Il 10 febbraio 2011 la Conferenza Stato Regioni ha quindi approvato il âDocumento tecnico di indirizzo per ridurre il carico di malattia del cancro. Anni 2011-2013â (8), poi confermato con lâintesa Stato-Regioni del 30 ottobre 2014 âDocumento tecnico di indirizzo per ridurre il burden del cancro. Anni 2014-2016â (9), che ha avvalorato il processo di pianificazione nazionale per lâoncologia rafforzando lâazione di Regioni e Ministero nella lotta contro il cancro. Tale intesa ha prorogato al 31 dicembre 2016 la validità del documento tecnico del 2011 e previsto il recepimento di tre importanti documenti, redatti su mandato della stessa intesa: la guida per la costituzione di reti oncologiche regionali, il buon uso delle risorse in oncologia e lâhealth technology assessment in oncologia.
In altri documenti di programmazione sanitaria nazionale si ritrovano azioni riconducibili a quelle previste dal NCCP. In particolare, il Piano Nazionale per la Prevenzione 2014-2018, nellâambito dellâobiettivo âRidurre il carico prevenibile ed evitabile di morbosità , mortalità e disabilità delle malattie croniche non trasmissibiliâ, definisce gli interventi di prevenzione primaria e di screening per i tumori della mammella, della cervice uterina e del colon-retto (10). Invece, il Piano Nazionale della Cronicità (11), non prevede alcuna sezione sulle malattie neoplastiche, nonostante formalmente incluse dallâOMS nelle malattie croniche non trasmissibili. Da rilevare, infine, che il DPCM 12 gennaio 2017 sui nuovi livelli essenziali di assistenza non include formalmente la riabilitazione oncologica.
Dallâanalisi dei documenti di programmazione sanitaria emergono in sintesi tre criticità fondamentali: innanzitutto la loro frammentarietà ; in secondo luogo lâimpossibilità di identificare un NCCP secondo i criteri definiti dallâOMS; infine, la consapevolezza che il monitoraggio sistematico delle azioni previste â in particolare per rilevare le differenze regionali â è inesistente, fatta eccezione per due indicatori inclusi nellâadempimento del mantenimento dei livelli essenziali di assistenza (12) (screening oncologici e posti letto attivi in hospice) e per gli indicatori sulle procedure di chirurgia oncologica incluse nel Programma Nazionale Esiti (13).
In occasione del World Cancer Day 2017 lâOMS ha pubblicato una guida sulla diagnosi precoce dei tumori con lâobiettivo di migliorare le possibilità di sopravvivenza per i pazienti oncologici, esortando a concentrarsi sulla diagnosi e il trattamento precoce della malattia (14). Infatti, anche nei paesi con sistemi sanitari allâavanguardia, la diagnosi di tumore è spesso tardiva e la conseguente impossibilità di fornire trattamenti adeguati condanna molte persone a inutili sofferenze e a morte precoce. LâOMS ha inoltre puntualizzato che la diagnosi precoce dei tumori riduce notevolmente anche lâimpatto economico di queste patologie, sia perché il costo complessivo dei trattamenti è inferiore nelle fasi iniziali della malattia, sia perché i pazienti possono continuare a lavorare e sostenere le loro famiglie.
LâOMS puntualizza in maniera rigorosa che screening e diagnosi precoce, spesso considerati sinonimi, presentano differenze fondamentali per risorse e infrastrutture necessarie, impatto e costi (figura 1). Lo screening mira a identificare tumori non riconosciuti o lesioni pre-cancerose in una popolazione asintomatica, apparentemente sana, attraverso test diagnostici (mammografia, ricerca del sangue occulto nelle feci, PAP test, test HPV, etc.) con lâobiettivo di ridurre la mortalità tumore-specifica. Lo screening è efficace solo in alcuni casi che giustificano lâofferta di programmi organizzati di screening: in particolare, in Italia i livelli essenziali di assistenza offrono, sulla base delle evidenze scientifiche, programmi di screening per il carcinoma della mammella della cervice uterina e del colon retto, la cui reale copertura presenta notevoli differenze regionali (12).
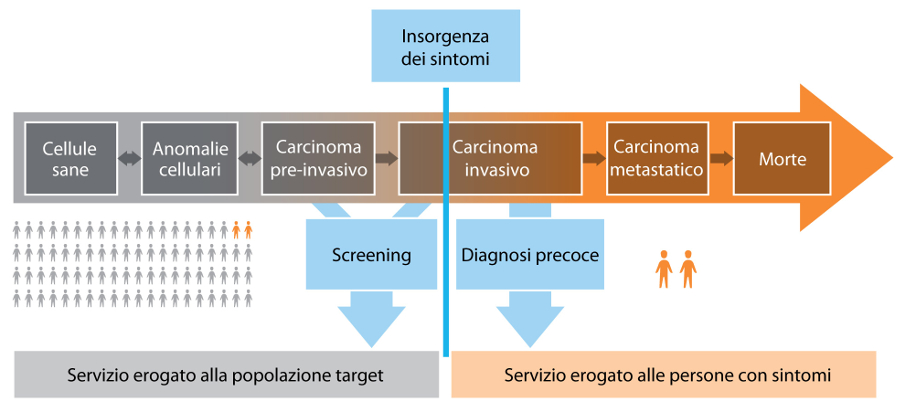
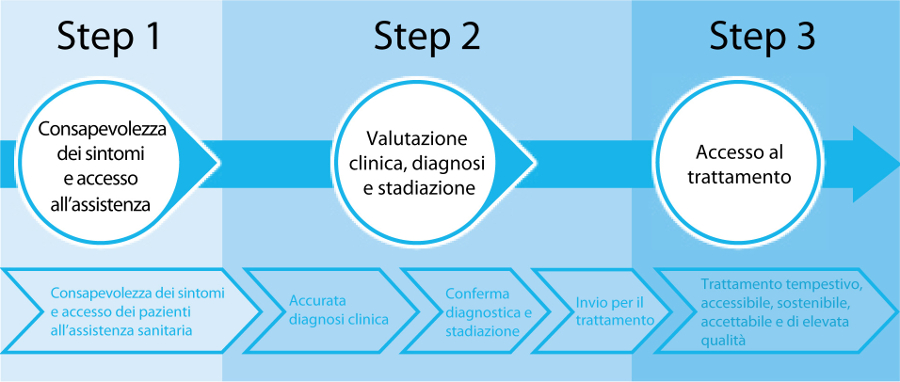
La diagnosi precoce consiste, invece, nellâidentificazione tempestiva di una neoplasia in persone che presentano già segni o sintomi della malattia. Lâobiettivo è quello di identificare il tumore a uno stadio potenzialmente curabile al fine di iniziare la terapia prima possibile, migliorando sopravvivenza e qualità di vita. Una diagnosi precoce efficace prevede 3 step integrati (figura 2):
- migliorare nella popolazione la consapevolezza dei vari sintomi delle neoplasie e incoraggiare le persone sintomatiche a rivolgersi al proprio medico;
- migliorare le capacità di diagnosi precoce dei medici, grazie a raccomandazioni cliniche evidence-based e interventi di formazione continua efficaci nel modificare i comportamenti professionali;
- garantire ai pazienti con diagnosi di tumore lâaccesso a trattamenti efficaci e sicuri, incluse le cure palliative.
Secondo lâOMS dal riconoscimento dei sintomi allâinizio della terapia non dovrebbero trascorrere più di 90 giorni, al fine di ridurre ritardi nellâassistenza, evitare di perdere pazienti al follow-up e massimizzare lâefficacia delle terapie (15). Ovviamente il target temporale può variare tra diversi sistemi sanitari e tra differenti neoplasie, ma è fondamentale che in tutti i setting assistenziali la diagnosi precoce venga gestita con modelli organizzativi tempo-dipendenti. Infatti, ridurre i ritardi nel percorso diagnostico-terapeutico determina un miglioramento degli outcome analogo o superiore ai benefici ottenuti nei trial clinici con la chemioterapia. In ogni caso, non tutte le neoplasie beneficiano allo stesso modo di questa strategia: a trarre maggior beneficio sono le neoplasie frequenti, che danno segni e sintomi clinici e per i quali esiste un trattamento efficace.
Nel dicembre 2015 la Fondazione GIMBE ha pubblicato un position statement finalizzato ad aumentare il value degli screening oncologici (16): oggi infatti da un lato vengono sovra-utilizzati screening dal basso value, che a fronte di benefici incerti presentano rischi reali e consumano preziose risorse, dallâaltro rimangono ampiamente sotto-utilizzate strategie ad elevato value, efficaci nel ridurre la mortalità tumore specifica offerte allâinterno dei programmi organizzati di screening.
Considerato che nel processo di diagnosi precoce dei tumori esiste unâestrema variabilità nella prescrizione di test diagnostici e nelle richieste di consulti specialistici, non giustificata dalla variabilità della popolazione, la Fondazione GIMBE ha elaborato il presente position statement con lâobiettivo di:
- fornire raccomandazioni evidence-based finalizzate alla diagnosi precoce di neoplasie maligne in bambini, giovani e adulti;
- definire a livello di cure primarie i criteri di appropriatezza per test diagnostici e consulti specialistici;
- aumentare nei pazienti la consapevolezza dei sintomi, aiutandoli a riconoscere le presentazioni cliniche suggestive di neoplasia.
Da una revisione sistematica delle linee guida disponibili è stata identificata quella del National Institute for Health and Care Excellence (NICE) non solo per il rigore metodologico e il recente aggiornamento (giugno 2016), ma anche perchè è lâunica linea guida che utilizza evidenze prodotte in setting di cure primarie, ovvero dove generalmente inizia il processo di diagnosi precoce dei tumori, considerato che le persone fanno riferimento in prima istanza al medico di famiglia (17).
Uniformando alcune terminologie (box 1) e seguendo una rigorosa metodologia (box 2) le raccomandazioni della LG sono state sviluppate utilizzando una âsoglia di rischioâ al di sopra della quale viene raccomandata la prescrizione di test diagnostici e/o la richiesta di consulto specialistico. Al fine di migliorare il processo diagnostico, il gruppo che ha sviluppato la LG — Guideline Development Group (GDG) — ha adottato una soglia di valore predittivo del test positivo (VP+) <5%. Tenendo in considerazione lâimpatto economico e clinico di ampliare le raccomandazioni, il GDG ha deciso di utilizzare un VP+ soglia del 3% per la richiesta di consulto specialistico per sospetta neoplasia e per test urgenti (es. TAC/RM cerebrale o endoscopia), con alcune eccezioni: in particolare, le raccomandazioni per bambini e giovani sono state formulate sotto la soglia del 3%, senza stabilire esplicitamente alcun valore soglia. Inoltre, la soglia non è stata applicata alle raccomandazioni relative ai test di routine disponibili a livello di cure primarie (es. PSA, Rx torace) e a quelli che possono sostituire i consulti specialistici di routine. Ulteriori informazioni sui metodi utilizzati per formulare le raccomandazioni sono disponibili nella versione integrale della LG.
| Box 1. Glossario FASCE DI ETÀ TIMING EROGAZIONE PRESTAZIONI* DEFINIZIONI CLINICHE E ORGANIZZATIVE
|
| Box 2. Metodi Scopo e sviluppo della linea guida
Gruppi inclusi
Gruppi non inclusi
Destinatari
Sviluppo della linea guida
Forza delle raccomandazioni
|
Alcuni fattori di rischio (es. età , familiarità ) aumentano la probabilità di sviluppare un tumore, ma non ne influenzano la presentazione clinica. Tra i fattori di rischio riportati in letteratura, solo il fumo (per il carcinoma polmonare) e lâetà influenzano significativamente la possibilità che i sintomi siano predittivi del tumore: di conseguenza sono stati inclusi nelle raccomandazioni se rilevanti. Per tutti gli altri fattori di rischio, le raccomandazioni sono le stesse per tutti le persone con sintomi di sospetta neoplasia, indipendentemente dalla presenza o meno di fattori di rischio. Lâunica eccezione riguarda lâesposizione allâasbesto, considerato lâelevato rischio di mesotelioma associato.
Le raccomandazioni della LG riguardano lâidentificazione di persone di tutte le età , inclusi bambini e giovani, con sospetto di neoplasia e la richiesta di consulto specialistico o ulteriori test diagnostici a livello di cure primarie. Per i tumori legati al genere vengono utilizzati i termini âuominiâ e âdonneâ, anche se le raccomandazioni si estendono alle persone che hanno cambiato sesso, o lo stanno cambiando e hanno ancora gli organi pertinenti. La LG ha lâobiettivo di aumentare la consapevolezza nei pazienti dei sintomi di tumore, di orientare il sospetto diagnostico nei medici e di guidare la programmazione dei servizi da offrire alle persone con sospetta neoplasia.
Le raccomandazioni, che non sostituiscono in alcun modo il giudizio clinico, sono organizzate in differenti sezioni: nella sezione 1 le raccomandazioni sono organizzate per sede della sospetta neoplasia, mentre nella sezione 2 per sintomi/segni e risultati di test diagnostici eseguiti a livello di cure primarie. Le sezioni 3, 4 e 5 forniscono rispettivamente raccomandazioni generali su informazioni e supporto al paziente, sulla ârete di protezioneâ e sul processo diagnostico. Infine, nella sezione 6 vengono formulate le raccomandazioni per la ricerca futura.
Lâapplicabilità delle raccomandazioni cliniche NICE nel nostro Paese è condizionata da alcune variabili di contesto che possono richiedere un adattamento locale nella costruzione dei percorsi assistenziali. Innanzitutto, alcune raccomandazioni sono applicabili solo occasionalmente perchè a livello di cure primarie non vengono di solito effettuate alcune valutazioni cliniche (es. esame ginecologico, visita odontostomatologica, etc); in secondo luogo, la modalità di esecuzione dei test diagnostici âad accesso direttoâ nellâambito delle cure primarie è poco frequente e, in ogni caso, condizionata dai modelli organizzativi sia regionali che locali oltre che dalla disponibilità nellâambulatorio del medico di medicina generale o del pediatra di libera scelta di effettuare test diagnostici di primo livello; inoltre non câè una perfetta sovrapposizione tra i timing raccomandati dalla LG per lâesecuzione di test diagnostici e visite specialistiche e quelli italiani — secondo il Piano Nazionale per il Governo delle Liste di Attesa (PNGLA) 2010-2012 (box 3) — peraltro non omogenei tra le varie Regioni; infine dalla reale implementazione dei percorsi diagnostico terapeutici (PDT) per lâarea oncologica previsti dal PNGLA che prevede di erogare la visita specialistica entro 30 giorni.
| Box 3. Il Piano Nazionale di Governo delle Liste di Attesa In attesa del nuovo Piano Nazionale di Governo delle Liste di Attesa (PNGLA) 2016-2018, in Italia il riferimento legislativo è rappresentato il PNGLA 2010-2012, pubblicato in Gazzetta Ufficiale il 23 novembre 2010. Le Regioni sono chiamate a rispettare i tempi massimi di attesa per le prestazioni indicate nel PNGLA:
1. Prestazioni diagnostiche e specialistiche
Se nella ricetta non sono indicati il sospetto diagnostico o la classe di priorità , la richiesta è collocata in classe P. Tra tutte le prestazioni offerte dal SSN, il PNGLA ne ha individuate 43 a livello ambulatoriale (14 visite specialistiche e 29 diagnostiche) il cui tempo massimo dâattesa deve essere garantito al 90% degli utenti. 2. Prestazioni in regime di ricovero, in day hospital e day surgery
Tra tutte le prestazioni offerte dal SSN, il PNGLA ne ha individuate 15 in regime di ricovero (5 day hospital/day surgery e 10 in regime di ricovero ordinario), il cui tempo massimo dâattesa deve essere garantito al 90% degli utenti. 3. Percorsi diagnostico terapeutici (PDT) per lâarea oncologica e cardiovascolare
Il rispetto di questi tempi è garantito in linea teorica per il 90% dei pazienti. *Le prestazioni urgenti devono essere prenotate entro 48 ore dalla data di prescrizione, pena la decadenza dellâindicazione urgente. |
1. RACCOMANDAZIONI CLINICHE PER SEDE DELLA SOSPETTA NEOPLASIA
In questa sezione vengono formulate le raccomandazioni per la richiesta di test diagnostici e consulti specialistici in relazione al sospetto di specifiche neoplasie classificate per sede:
- Polmone e pleura
- Tratto gastrointestinale superiore
- Tratto gastrointestinale inferiore
- Mammella
- Apparato genitale femminile
- Vie urinarie e apparato genitale maschile
- Cute
- Testa e collo
- Sistema nervoso centrale
- Sistema emolinfopoietico
- Sarcomi
- Tumori esclusivi dellâetà pediatrica
- Sintomi non sede-specifici
1.1. TUMORI DEL POLMONE E DELLA PLEURA
Carcinoma polmonare
1.1.1 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) per le persone con:
- Rx torace suggestiva di carcinoma polmonare, oppure
- età ≥40 anni ed emottisi inspiegata
1.1.2 Richiedere una Rx torace (entro 2 settimane) per le persone con:
- età ≥40 anni e almeno due dei seguenti sintomi inspiegati, oppure
- età ≥40 anni fumatori o ex-fumatori e almeno uno dei seguenti sintomi:
- tosse
- astenia
- respiro corto
- dolore toracico
- calo ponderale
- perdita di appetito
1.1.3 Considerare una Rx torace (entro 2 settimane) nelle persone di età ≥40 anni che presentano almeno uno dei seguenti sintomi:
- bronco-polmonite ricorrente o persistente
- dita a bacchetto di tamburo
- linfoadenopatia sovra-clavicolare o cervicale persistente
- segni polmonari compatibili con neoplasia
- trombocitosi
Mesotelioma
1.1.4 Richiedere consulto specialistico per sospetta neoplasia (entro due settimane) nelle persone con Rx torace suggestiva di mesotelioma.
1.1.5 Richiedere una Rx torace (entro 2 settimane) nelle persone di età ≥40 anni se sono presenti:
- 2 o più dei seguenti sintomi inspiegati, oppure
- 1 o più dei seguenti sintomi inspiegati in fumatori, oppure
- 1 o più dei seguenti sintomi inspiegati, in persone con storia di esposizione allâasbesto:
- tosse
- astenia
- respiro corto
- dolore toracico
- calo ponderale
- perdita di appetito
1.1.6 Considerare una Rx torace (entro 2 settimane) nelle persone di età ≥40 anni che presentano:
- dita a bacchetto di tamburo, oppure
- segni toracici compatibili con una patologia pleurica
1.2. TUMORI DEL TRATTO GASTROINTESTINALE SUPERIORE
Carcinoma dellâesofago
1.2.1 Richiedere unâendoscopia del tratto gastrointestinale superiore (entro 2 settimane) nelle persone:
- con disfagia, oppure
- di età ≥55 anni, che presentano calo ponderale e almeno uno dei seguenti sintomi:
- dolore epigastrico
- reflusso gastro-esofageo
- dispepsia
1.2.2 Richiedere unâendoscopia del tratto gastrointestinale superiore (entro 48 ore) nei pazienti con ematemesi.
1.2.3 Considerare unâendoscopia del tratto gastrointestinale superiore differibile nelle persone di età ≥55 anni con:
- dispepsia resistente al trattamento, oppure
- dolore epigastrico e anemia, oppure
- trombocitosi associata a uno dei seguenti sintomi:
- nausea
- vomito
- calo ponderale
- reflusso gastro-esofageo
- dispepsia
- dolore epigastrico, oppure
- nausea o vomito associati a uno dei seguenti sintomi:
- calo ponderale
- reflusso gastro-esofageo
- dispepsia
- dolore epigastrico
Carcinoma del pancreas
1.2.4 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone di età ≥40 anni che presentano ittero.
1.2.5. Considerare una TAC (entro 2 settimane) o, se non disponibile unâecografia per le persone di età ≥60 anni che presentano calo ponderale associato a uno dei seguenti sintomi:
- diarrea
- lombalgia
- dolore addominale
- nausea
- vomito
- stitichezza
- diabete di recente insorgenza
Carcinoma gastrico
1.2.6. Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone con massa epigastrica palpabile.
1.2.7. Richiedere unâendoscopia del tratto gastrointestinale superiore (entro 2 settimane) nelle persone:
- con disfagia, oppure
- di età ≥55 anni che presentano calo ponderale associato a uno dei seguenti sintomi:
- dolore epigastrico
- reflusso gastro-esofageo
- dispepsia
1.2.8. Richiedere unâendoscopia del tratto gastrointestinale superiore (entro 48 ore) nei pazienti con ematemesi.
1.2.9. Considerare unâendoscopia del tratto gastrointestinale superiore differibile nelle persone di età ≥55 anni che presentano:
- dispepsia resistente al trattamento, oppure
- dolore epigastrico e anemia, oppure
- trombocitosi associata a uno dei seguenti sintomi:
- nausea
- vomito
- calo ponderale
- reflusso gastro-esofageo
- dispepsia
- dolore epigastrico, oppure
- nausea o vomito associato a uno dei seguenti sintomi:
- calo ponderale
- reflusso gastro-esofageo
- dispepsia
- dolore epigastrico
Carcinoma della colecisti
1.2.10 Considerare unâecografia (entro 2 settimane) nelle persone con massa nellâaddome superiore compatibile con un aumento della colecisti.
Epatocarcinoma
1.2.11 Considerare unâecografia (entro 2 settimane) nelle persone con epatomegalia.
1.3 TUMORI DEL TRATTO GASTROINTESTINALE INFERIORE
Carcinoma del colon-retto
1.3.1 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone:
- di età ≥40 anni che presentano calo ponderale inspiegato e dolore addominale, oppure
- di età ≥50 anni e rettorragia inspiegata, oppure
- di età ≥60 anni con:
- anemia sideropenica, oppure
- alterazioni dellâalvo, oppure
- test positivo per la ricerca di sangue occulto nelle feci (cfr. 1.3.4 per le persone a cui dovrebbe essere prescritto il test)
1.3.2 Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone con massa addominale o rettale.
1.3.3. Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone di età <50 anni che presentano rettorragia di origine sconosciuta associata a uno dei seguenti sintomi inspiegati:
- dolore addominale
- alterazioni dellâalvo
- calo ponderale
- anemia sideropenica
1.3.4. Richiedere il test per la ricerca di sangue occulto nelle feci nelle persone senza rettorragia:
- ≥50 anni con uno dei seguenti sintomi inspiegati:
- dolore addominale, oppure
- calo ponderale, oppure
- <60 anni con:
- alterazioni dellâalvo, oppure
- anemia sideropenica, oppure
- ≥60 anni con anemia, anche in assenza di carenza marziale
Carcinoma anale
1.3.5 Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone con inspiegata massa o ulcera anale.
1.4 TUMORI DELLA MAMMELLA
1.4.1 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone:
- di età ≥30 anni con un nodulo mammario inspiegato associato o meno a dolore, oppure
- di età ≥50 anni con uno dei seguenti segni/sintomi in un solo capezzolo:
- secrezione
- retrazione
- altre alterazioni rilevanti
1.4.2 Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone:
- con alterazioni cutanee suggestive di carcinoma mammario, oppure
- di età ≥30 anni e un nodulo ascellare inspiegato
1.4.3 Considerare un consulto specialistico differibile nelle persone di età <30 anni che presentano un nodulo mammario inspiegato associato o meno a dolore.
1.5 TUMORI DELLâAPPARATO GENITALE FEMMINILE
Carcinoma ovarico
Le raccomandazioni sul carcinoma ovarico si applicano alle donne di età ≥18 anni.
1.5.1 Richiedere un consulto specialistico (entro 2 settimane) se allâesame obiettivo è presente ascite e/o una massa addominale o pelvica (non compatibile con un fibroma uterino).
1.5.2 Richiedere test diagnostici (cfr. raccomandazioni da 1.5.6. a 1.5.9) se una donna (in particolare se di età ≥50 anni) riporta uno dei seguenti sintomi in maniera persistente o frequente (in particolare oltre 12 volte/mese):
- persistente distensione addominale (riferita spesso come âgonfioreâ)
- sensazione di pienezza (sazietà precoce) e/o perdita di appetito
- dolore addominale o pelvico
- pollachiuria e/o minzione urgente
- astenia
1.5.3 Considerare test diagnostici (cfr. raccomandazioni da 1.5.6. a 1.5.9) se una donna riferisce un inspiegato calo ponderale, affaticamento o modificazioni dellâalvo.
1.5.4 Consigliare alle donne senza sospetto di carcinoma ovarico di tornare dal proprio medico di famiglia se i sintomi dovessero diventare più frequenti o persistenti.
1.5.5 Richiedere accertamenti diagnostici specifici per il carcinoma ovarico (cfr. raccomandazioni da 1.5.6. a 1.5.9) nelle donne di età ≥50 anni che negli ultimi 12 mesi hanno sperimentato sintomi suggestivi di sindrome del colon irritabile, che raramente si insorge in questa fascia dâetà .
1.5.6 Richiedere il CA125 nelle donne con sintomi suggestivi di carcinoma ovarico (cfr. raccomandazioni da 1.5.1 al 1.5.5).
1.5.7 Se il CA125 è =35 UI/ml, richiedere unâecografia addominale e pelvica.
1.5.8 Se lâecografia è suggestiva di carcinoma ovarico, richiedere ulteriori test diagnostici urgenti.
1.5.9 Se il valore di CA125 è nella norma (<35 UI/ml), oppure se è ≥35 IU/ml e lâecografia è negativa:
- valutare accuratamente la donna per altre cause che possano giustificare la sintomatologia e, se necessario, richiedere ulteriori test diagnostici
- se non è possibile indentificare altre cause che giustifichino la sintomatologia, consigliare alla donna di ritornare dal medico di famiglia se i sintomi dovessero diventare più frequenti o persistenti
Carcinoma endometriale
1.5.10 Richiedere un consulto specialistico urgente (entro 2 settimane) per le donne di età ≥55 anni con metrorraggia post-menopausale (sanguinamento vaginale inspiegato dopo almeno 1 anno dalla cessazione delle mestruazioni per menopausa).
1.5.11 Considerare un consulto specialistico urgente (entro 2 settimane) per le donne di età <55 anni con metrorragia post-menopausale.
1.5.12 Considerare unâecografia ad accesso diretto nelle donne di età ≥55 anni che presentano:
- perdite vaginali inspiegate e che:
- lamentano questi sintomi per la prima volta, oppure
- presentano trombocitosi, oppure
- presentano ematuria, oppure
- macroematuria associata a:
- anemia, oppure
- trombocitosi, oppure
- iperglicemia
Carcinoma della cervice uterina
1.5.13 Considerare un consulto specialistico urgente (entro 2 settimane) per le donne che presentano allâesame obiettivo un aspetto della cervice compatibile con carcinoma.
Carcinoma vulvare
1.5.14 Considerare un consulto specialistico urgente (entro 2 settimane) per le donne con massa vulvare, ulcere o emorragia inspiegati.
Carcinoma vaginale
1.5.15 Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) per le donne con massa palpabile inspiegata intravaginale o nel vestibolo vulvare.
1.6. TUMORI DELLE VIE URINARIE E DELLâAPPARATO GENITALE MASCHILE
Carcinoma della prostata
1.6.1 Richiedere un consulto specialistico (entro 2 settimane) negli uomini la cui parete prostatica ha caratteristiche di malignità allâesplorazione rettale.
1.6.2 Considerare il test del PSA e lâesplorazione rettale negli uomini con:
- sintomi delle basse vie urinarie quali nicturia, minzione urgente, disuria, incontinenza o ritenzione urinaria, oppure
- disfunzione erettile, oppure
- macroematuria
1.6.3 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane), se i livelli di PSA sono superiori ai range di riferimento per la fascia di età .
Carcinoma della vescica
1.6.4. Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone:
- di età ≥45 anni che presentano
- macroematuria inspiegata non associata a infezione delle vie urinarie (IVU), oppure
- macroematuria che persiste o si ripresenta dopo unâIVU trattata con successo, oppure
- di età ≥60 anni che presentano microematuria inspiegata e disuria e/o leucocitosi
1.6.5 Considerare un consulto specialistico differibile per sospetta neoplasia nelle persone di età ≥60 anni con IVU inspiegate ricorrenti o persistenti.
Carcinoma renale
1.6.6. Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone di età ≥45 anni che presentano:
- macroematuria inspiegata non associata a IVU, oppure
- macroematuria che persiste o si ripresenta dopo unâIVU trattata con successo
Carcinoma del testicolo
1.6.7. Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) negli uomini che presentano un aumento di volume del testicolo non dolente, oppure un cambiamento della forma o della struttura del testicolo.
1.6.8. Considerare unâecografia urgente negli uomini con sintomi ai testicoli inspiegati o persistenti.
Carcinoma del pene
1.6.9. Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) negli uomini che presentano:
- una massa a livello del pene oppure unâulcera non conseguente a infezione sessualmente trasmessa, oppure
- una lesione persistente al pene dopo aver completato la terapia di una infezione sessualmente trasmessa
1.6.10 Considerare un consulto specialistico per sospetta neoplasia (entro 2 settimane) negli uomini con sintomi inspiegati o persistenti al glande o al prepuzio.
1.7. TUMORI DELLA CUTE
Melanoma maligno
1.7.1 Richiedere un consulto specialistico per sospetta neoplasia (entro 2 settimane) nelle persone che presentano una lesione cutanea pigmentata sospetta con uno score >3 sulla checklist ponderata a 7 punti (box 4).
| Box 4. Checklist a 7 punti Caratteristiche principali della lesione cutanea (attribuire 2 punti a ciascuna):
Caratteristiche secondarie della lesione cutanea (attribuire 1 punto a ciascuna)
|



