Best practice
Evidence 2013;5(7): e1000052 doi: 10.4470/E1000052
Pubblicato: 29 luglio 2013
Copyright: © 2013 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Il carcinoma familiare della mammella (CFM) si presenta in pazienti con uno o più familiari affetti da carcinoma della mammella (CM), delle ovaie o da neoplasie correlate, come quelle peritoneali primitive. Oggi si stima che circa il 5% dei CM può essere attribuito a mutazioni ereditarie di specifici geni ad alto rischio quali BRCA1, BRCA2, TP53.
Questo articolo sintetizza le più recenti raccomandazioni del National Institute for Health and Care Excellence (NICE) sulla classificazione del CFM e l’assistenza delle persone a rischio elevato di CFM (1). Queste linee guida, che aggiornano quelle del 2004 (2) e del 2006 (3), forniscono nuove raccomandazioni per donne e uomini con una nuova o pregressa diagnosi di CM che hanno una storia familiare di CM e delle ovaie, non considerati nelle versioni precedenti (4).
Le raccomandazioni del NICE sono basate su una revisione sistematica delle migliori evidenze disponibili e sull’esplicita considerazione della costo-efficacia degli interventi sanitari. Quando le evidenze sono limitate, le raccomandazioni si basano sull’esperienza del gruppo che ha prodotto la linea guida – Guidelines Development Group (GDG) – e sulle norme di buona pratica clinica. I livelli di evidenza delle raccomandazioni cliniche sono indicati in corsivo tra parentesi quadre.
1. Informazione e supporto ai pazienti
- Offrire ai pazienti informazioni personalizzate, inclusi i contatti di servizi e organizzazioni di supporto locali o nazionali. [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
2. Valutazione iniziale nel setting di cure primarie di persone senza storia personale di carcinoma della mammella
- Quando un soggetto senza storia di CM presenta sintomi mammari o manifesta preoccupazioni per familiari affetti da CM, al fine di valutare adeguatamente il suo rischio individuale è indispensabile raccogliere la storia familiare relativamente ai parenti di primo e secondo grado permettendo così una classificazione e assistenza adeguate.
- Cercare di ottenere informazioni accurate su ogni diagnosi di carcinoma nei familiari: età alla diagnosi, sede delle neoplasie, neoplasie multiple (inclusi eventuali casi di malattia bilaterale), ascendenza ebraica.
- Richiedere una consulenza specialistica per valutare il rischio di CM se la persona soddisfa almeno uno dei seguenti criteri:
- familiare di primo grado donna con diagnosi di CM a un età < 40 anni.
- familiare di primo grado uomo con diagnosi di CM a qualunque età .
- familiare di primo grado con diagnosi di CM bilaterale e neoplasia primaria diagnosticata a un età < 50 anni.
- due familiari di primo grado, o un familiare di primo grado e uno di secondo grado con diagnosi di CM a qualunque età .
- un familiare di primo o secondo grado con diagnosi di CM a qualunque età e un familiare di primo o secondo grado con diagnosi di carcinoma ovarico a qualunque età (almeno uno dei due deve essere di primo grado).
- tre familiari di primo o secondo grado dallo stesso ramo familiare con diagnosi di CM a qualunque età .
- Le persone che non soddisfano nessuno di questi criteri hanno un rischio di CM simile a quello della popolazione generale. Di conseguenza, devono essere solo rassicurate e non necessitano di consulenza specialistica per valutare il rischio di CM.
3. Identificazione dei portatori del gene tra le persone con o senza storia personale di carcinoma della mammella
- Per identificare le persone da inviare ad una clinica genetica specializzata utilizzare, oltre alla storia familiare - se disponibile in un setting di assistenza secondaria - un metodo di documentata affidabilità per calcolare la probabilità che la persona sia portatrice del gene BRCA1/BRCA2 (es. BOADICEA e lo score di Manchester (5,6) ) . [Raccomandazione basata su evidenze di qualità moderata da studi diagnostici]
- Offrire la possibilità di test genetici presso centri accreditati a tutte le persone che hanno una probabilità ≥ 10% di essere portatori di una mutazione combinata nei geni BRCA1/BRCA2 [Raccomandazione basata su evidenze di costo-efficacia di qualità moderata]
Idealmente dovrebbero essere sottoposti a test genetici i familiari con una storia personale di CM o di carcinoma ovarico. Tuttavia, è possibile effettuare i test ai soggetti sani se il familiare malato non è disponibile. Il trattamento dei pazienti con nuova diagnosi di CM potrebbe essere diverso se si tratta di una forma familiare, ma non ci sono evidenze da trial clinici che supportino l’esecuzione di test genetici entro 4 settimane dalla diagnosi di CM.
- Ai soggetti eleggibili per l’invio al genetista consentire di effettuare i test genetici durante la fase iniziale della loro malattia o, successivamente, in qualsiasi momento. [Raccomandazione basata su evidenze di qualità molto bassa da studi osservazionali]
- Offrire l’accesso rapido ai test genetici (entro 4 settimane dalla diagnosi di CM) solo nell’ambito di sperimentazioni cliniche. [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
- Discutere dei potenziali rischi e benefici dei test genetici, affrontando nella discussione: la probabilità di rilevare un a mutazione, le implicazioni per l’individuo e i suoi familiari, le implicazioni conseguenti all’identificazione di una variante di significato incerto o al mancato riscontro della mutazione. [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
- Considerato che l’evoluzione delle conoscenze migliorerà l’identificazione del CMF, informare le famiglie con una diagnosi genetica incerta che in futuro potranno essere rivalutati da un genetista per ulteriori indagini. [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
4. Sorveglianza per il carcinoma della mammella
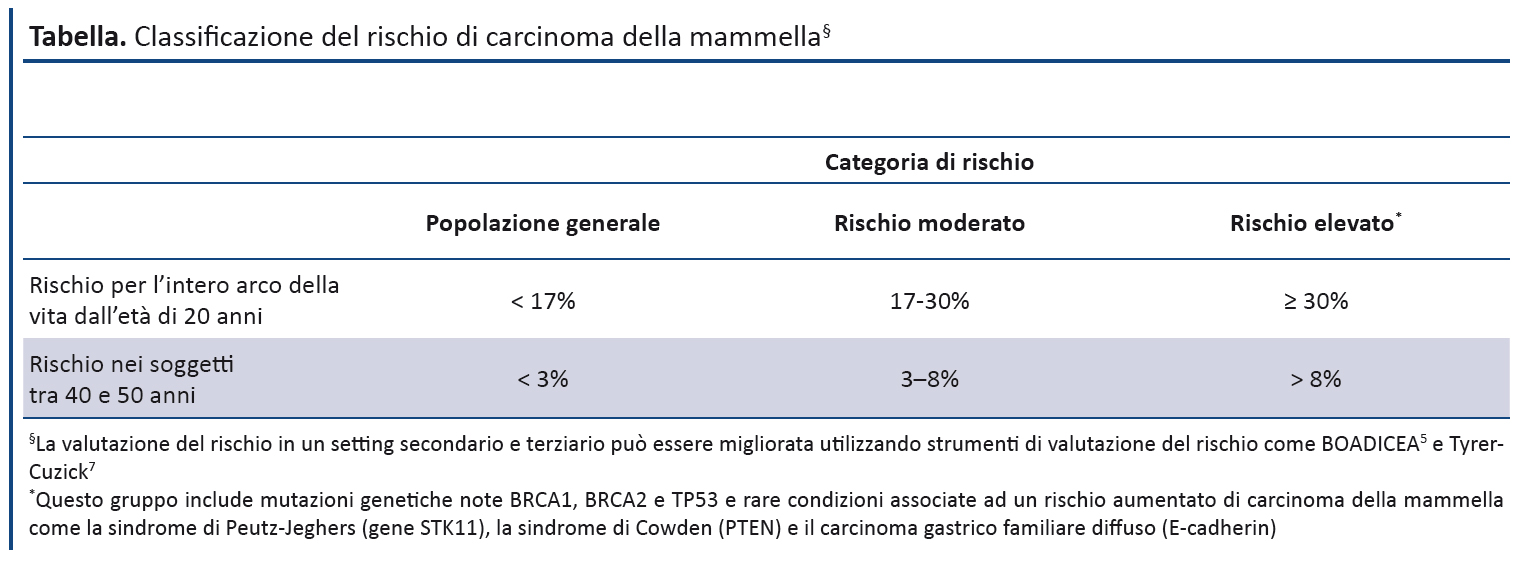
Le donne con una storia familiare di CM, con o senza una storia personale di CM, che secondo la valutazione specialistica (tabella) hanno un rischio da moderato a elevato e decidono di non sottoporsi a mastectomia preventiva, possono trarre beneficio da una sorveglianza radiologica.
- Assicurarsi che la mammografia digitale e la risonanza magnetica (RM) della mammella vengano eseguite secondo gli standard raccomandati. [Raccomandazione basata su evidenze di qualità moderata di costo-efficacia]
- Offrire la possibilità di eseguire ogni anno la RM nelle donne di 30-49 anni, con o senza una storia personale di CM, se portatrici di una mutazione BRCA1 o BRCA2 o alle donne che hanno una probabilità > 30% di essere portatrici di geni BRCA. [Raccomandazione basata su evidenze di qualità moderata di costo-efficacia]
- Offire la possibilità di eseguire ogni anno la mammografia le donne:
- tra 40 e 49 anni a rischio moderato di CM
- tra 40 e 59 anni a rischio elevato di CM ma con una probabilità ≤30% di essere portatrici di una mutazione BRCA o TP53
- tra 40 e 59 anni con una probabilità >30% di essere portatrici di BRCA
- tra 40 e 69 anni con una mutazione BRCA nota.
- Non sottoporre a mammografia le donne di età < 30 anni o le donne di qualunque età con una mutazione TP53 nota [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
- Non effettuare ecografie di routine nelle donne a rischio di CM moderato o elevato, tranne nei casi in cui la sorveglianza con la RM, di norma preferibile, non è fattibile (es. claustrofobia) o quando i risultati della mammografia o della RM sono di difficile interpretazione. [Raccomandazione basata sull’esperienza e sull’opinione del GDG]
5. Strategie per ridurre il rischio nelle donne senza storia personale di carcinoma della mammella
La terapia sostitutiva ormonale e l’uso di contraccettivi orali può aumentare il rischio di CM.
- Informare le donne di età >35 anni con storia familiare di CM che l’assunzione di contraccettivi orali aumenta il rischio di CM, indipendentemente dall’aumento del rischio assoluto dovuto all’età . [Raccomandazione basata su evidenze di qualità molto bassa da studi osservazionali]
- Discutere con le donne con mutazioni BRCA di rischi e benefici dei contraccettivi orali: da un lato potenziale aumento del rischio di CM a un età < 40 anni, dall’altro riduzione del rischio di carcinoma ovarico per l’intero arco della vita. [Raccomandazione basata su evidenze di qualità molto bassa da studi osservazionali]
- Comunicare alle donne con storia familiare di CM che stanno valutando o già assumendo una terapia sostitutiva ormonale che esiste un aumento del rischio di CM associato al tipo e alla durata di questa terapia. [Raccomandazione basata su evidenze di qualità molto bassa da studi osservazionali]
Recentemente alcuni trial clinici hanno dimostrato una significativa riduzione del rischio di CM con il tamoxifene e il raloxifene. Tuttavia, anche se costo-efficaci, entrambi i farmaci aumentano il rischio di eventi tromboembolici e il tamoxifene può causare il carcinoma endometriale. Dopo valutazione specialistica del rischio, alle donne senza storia di CM che non hanno un rischio aumentato di malattia tromboembolica o di tumore dell’endometrio:
- Prescrivere tamoxifene per 5 anni non ancora in menopausa e rischio elevato di CM. [Raccomandazione basata su evidenze di qualità da moderata a molto elevata da trial controllati randomizzati e analisi economiche]/li>
- Prescrivere tamoxifene per 5 anni se sono in menopausa, a rischio elevato di CM e isterectomizzate [Raccomandazione basata su evidenze di qualità da moderata a molto elevata da trial controllati randomizzati e analisi economiche]
- Prescrivere tamoxifene o raloxifene per 5 anni se sono in menopausa, a rischio elevato di CM con utero conservato. [Raccomandazione basata su evidenze di qualità da moderata a molto elevata da trial controllati randomizzati e analisi economiche]
- Considerare il tamoxifene per 5 anni non ancora in menopausa e a rischio moderato di sviluppare il CM nei successivi 10 anni. [Raccomandazione basata sull’esperienza e sull’opinione del GDG e analisi dei costi]
- Considerare il tamoxifene per 5 anni se sono in menopausa, a rischio moderato di sviluppare il CM nei successivi 10 anni e prive di utero/isterectomizzate. [Raccomandazione basata sull’esperienza e sull’opinione del GDG e analisi dei costi]
- Considerare il tamoxifene o il raloxifene per 5 anni se sono in menopausa, a rischio moderato di sviluppare il CM nei successivi 10 anni e con utero conservato [Raccomandazione basata sull’esperienza e sull’opinione del GDG e analisi dei costi]
6. Strategie per ridurre il rischio nelle donne con storia familiare di carcinoma della mammella o dell’ovaio
Le donne a rischio aumentato di CM o delle ovaie a causa della loro storia familiare, possono considerare la chirurgia tra le opzioni per ridurre il rischio. Le donne con una nuova diagnosi di CM possono avere opzioni chirurgiche differenti da quelle senza storia familiare di CM.
- Discutere rischi e benefici della mastectomia preventiva con le donne portatrici di una mutazione BRCA1, BRCA2 o TP53 sospetta o nota.
- Assicurarsi che gli interventi di mastectomia preventiva e di ricostruzione vengano effettuati da un team chirurgico con competenze specialistiche in chirurgia oncoplastica e ricostruttiva del seno.
- Discutere rischi e benefici della salpingo-ooforectomia bilaterale preventiva con le donne con una mutazione BRCA1, BRCA2 o TP53 sospetta o nota, includendo i benefici legati alla riduzione del rischio di CM e ovarico e gli effetti negativi della menopausa indotta chirurgicamente.
- Discutere benefici e rischi della terapia sostitutiva ormonale dopo ooforectomia nelle donne di età ≤ 50 anni senza diagnosi di CM.
7. Quali potenziali ostacoli per l’implementazione?
Le soglie più basse per i test genetici raccomandate aumenteranno il numero di rinvii a centri accreditati di genetica medica ma, secondo il parere del GDG, l’attuale infrastruttura dovrebbe essere in grado di soddisfare le richieste.
8. Quali raccomandazioni per la ricerca futura?
Il GDG ha identificato le seguenti priorità :
- Sviluppare e validare modelli per calcolare la probabilità di essere portatori di geni che includano dati aggiuntivi, quali la patologia molecolare dei tumori e la prevalenza delle mutazioni in relazione ai gruppi etnici.
- Determinare benefici e rischi di un accesso rapido ai test genetici per i soggetti con nuova diagnosi di CM, valutando sia il modello ottimale per l’erogazione e organizzazione, sia l’efficacia clinica e la costo-efficacia di un tale innovazione, gli esiti clinici e il feedback dei pazienti.
- Definire rischi e benefici dello screening con RM vs mammografia nelle donne di età > 50 anni con storia personale di CM; gli studi dovrebbero pianificare analisi per sottogruppi secondo la densità della mammella.
- Condurre un trial controllato randomizzato per confrontare efficacia e costo-efficacia degli inibitori dell’aromatasi vs tamoxifene per ridurre l’incidenza del CM nelle donne con storia familiare di CM o ovarico.
- Confrontare gli esiti clinici e psicologici nelle donne che scelgono di sottoporsi alla mastectomia preventiva vs quelle che non fanno questa scelta.



