Il punto di...
Evidence 2014;6(12): e1000099 doi: 10.4470/E1000099
Pubblicato: 18 dicembre 2014
Copyright: © 2014 Montanaro. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Gli studi no-profit costituiscono in Italia circa il 35% delle sperimentazioni cliniche esaminate dai comitati etici (CE) e il 25% di quelle sui farmaci che dovrebbero essere conformi a quanto definito dal DM del 17/12/2004, che regola l’esecuzione delle sperimentazioni cliniche dei medicinali senza finalità di lucro finalizzate al miglioramento della pratica clinica. Sono almeno tre le tipologie di promotori che presentano studi no-profit ai CE: aziende sanitarie, società scientifiche e onlus o fondazioni.
Suscita un certo stupore che circa la metà degli studi no-profit sui farmaci sia rappresentata da sperimentazioni di fase I-II, che difficilmente rispondono al requisito principale di miglioramento della pratica clinica, se non in una pretesa finalità a lungo termine di possibili benefici futuri. Tuttavia, al riconoscimento di queste proposte come studi no-profit giova l’articolo 6 del DM 17/12/2004, che ammette studi non immediatamente finalizzati al miglioramento della pratica clinica, purché soddisfino tutti gli altri requisiti dell’articolo 1 comma 2) ad eccezione della lettera e). Questo in parziale contraddizione con il titolo stesso del DM che pone un “particolare riferimento” al “miglioramento della pratica clinica quale parte integrante della assistenza sanitaria”.
Le risorse per la realizzazione degli studi no-profit in parte provengono dal finanziamento della ricerca indipendente tramite bandi nazionali o regionali, in particolare per gli studi di fase III e quelli su strategie terapeutiche. Invece, la quasi totalità dei numerosi studi di fase I e II si giova del “sostegno” di soggetti privati, quasi sempre aziende farmaceutiche. Queste, oltre a mettere a disposizione il farmaco in studio, offrono un contributo finanziario più o meno consistente mediante un accordo economico. Le clausole di questo contratto con il promotore richiedono un attento esame da parte dei CE per evitare un condizionamento del ricercatore nella condotta dello studio o nella pubblicazione dei risultati.
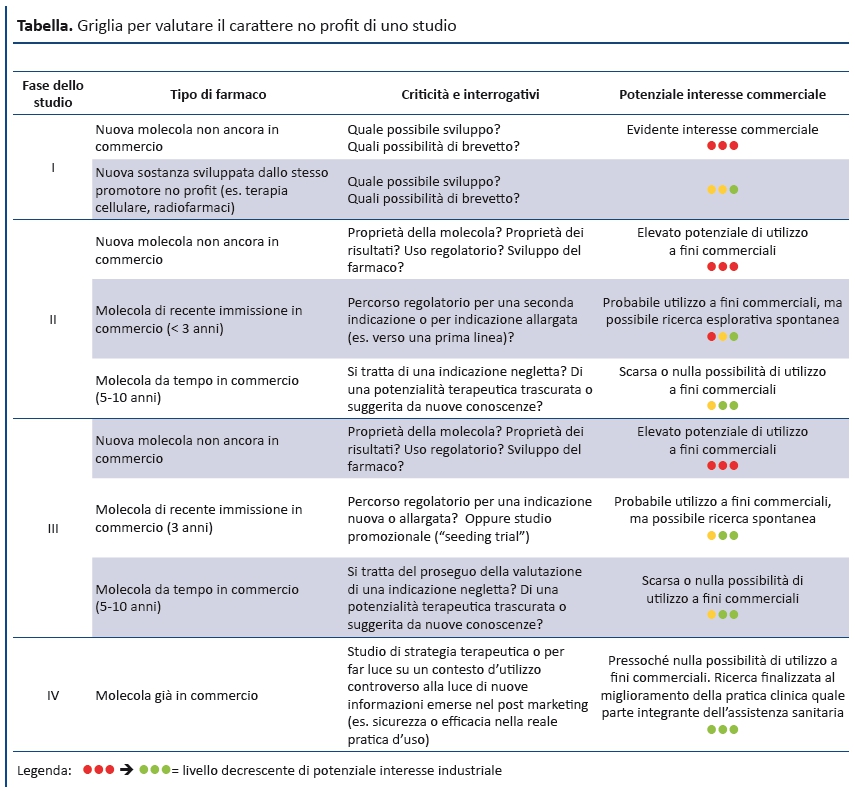
Schematicamente, le principali criticitĂ degli studi no-profit sono rappresentate da:
- studi di fase I-II su molecole nuove, cioè farmaci in via di sviluppo e quindi dal manifesto interesse industriale;
- supporto finanziario da parte di aziende farmaceutiche secondo contratti che impongono vincoli e condizioni, contrastando il carattere indipendente dello studio;
- la difficile interpretazione dell’art. 6 del DM 17/12/2004, che rimuove dai connotati dello studio quello del miglioramento della pratica clinica quale parte integrante dell’assistenza sanitaria.
Di conseguenza, i CE devono impegnarsi in una una scrupolosa valutazione degli obiettivi dichiarati degli studi no-profit e delle caratteristiche dei contratti di finanziamento degli enti sostenitori. Più in generale, la produzione di linee di indirizzo e checklist da parte dei CE per l’esame degli studi no-profit può assicurare una valutazione obiettiva con criteri uniformi. La circolazione di questi documenti tra i CE potrà favorire la consapevolezza di un orientamento e un approccio comuni. A tal proposito, la tabella riporta la griglia di valutazione recentemente adottata “in prova” dal CE Indipendente dell’Azienda Ospedaliero-Universitaria di Bologna Policlinico S.Orsola-Malpighi, con l’obiettivo di identificare la tipologia degli studi no-profit e l’individuazione di possibili criticità .
Alla luce dell’esperienza maturata nei dieci anni trascorsi dalla sua emanazione, emerge la necessità di rivedere il DM 17/12/2004, razionalizzandone le sezioni di difficoltosa interpretazione e applicazione. Inoltre, una normativa aggiornata dovrebbe riguardare anche gli studi interventistici no-profit sui dispositivi medici, nonché regolamentare il “sostegno economico” che le aziende produttrici di farmaci e dispositivi medici intendono erogare, assicurando la trasparenza e il rispetto del carattere no-profit degli studi.
Tabella. Griglia per valutare il carattere no profit di uno studio