Best practice
Evidence 2019;11(5): e1000197 doi: 10.4470/E1000197
Pubblicato: 31 maggio 2019
Copyright: © 2019 Fondazione GIMBE Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Anche se rappresentano solo il 3% di tutte le neoplasie, i tumori cerebrali maligni primitivi sono responsabili del maggior numero di anni di vita persi rispetto ad altre neoplasie (1), visto che la sopravvivenza rimane bassa nonostante i progressi diagnostico-terapeutici (tabella 1). Tuttavia, si presume che sopravvivenza e qualità di vita potrebbero migliorare standardizzando l’assistenza attraverso l’implementazione di una linea guida (LG) nazionale. Oltre il 60% dei pazienti affetti da tumori cerebrali primitivi riceve una diagnosi incidentale nei servizi di emergenza-urgenza, piuttosto che nelle cure primarie o in setting specialistici (2). Le metastasi cerebrali rappresentano i tumori cerebrali più frequentemente identificati nell’ambito delle cure primarie.

Sebbene il trattamento dei tumori cerebrali sia generalmente gestito da team multispecialistici, le cure primarie rivestono un ruolo importante, in particolare nella gestione degli effetti cognitivi, fisici e mentali a lungo termine del tumore e della terapia (tabella 1).
Questo articolo sintetizza le piĂą recenti raccomandazioni del National Institute for Health and Care Excellence (NICE) sul trattamento di gliomi, meningiomi e metastasi cerebrali (figura 1) (3). Le raccomandazioni riguardano in particolare il follow-up a lungo termine dei pazienti e le potenziali complicanze del trattamento piĂą rilevanti per i professionisti delle cure primarie, in particolare i medici di medicina generale (MMG).
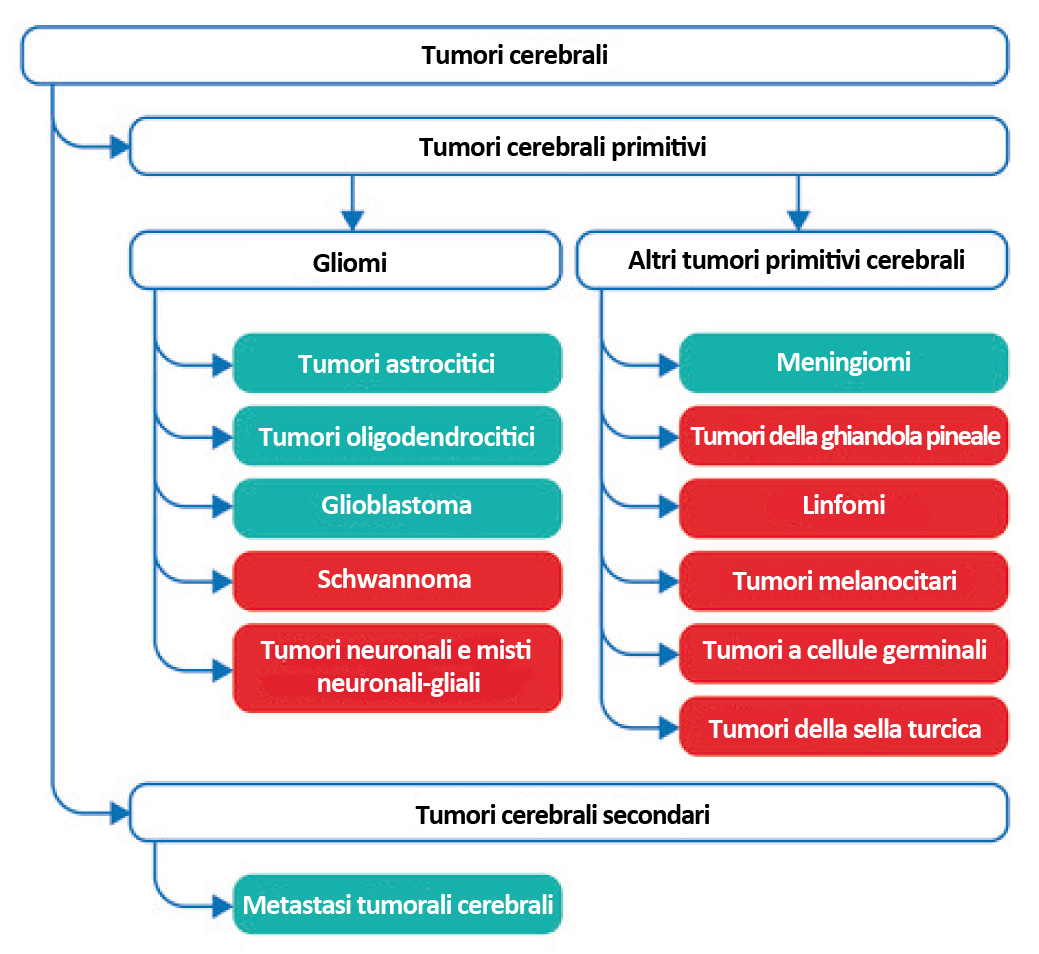
Le raccomandazioni del NICE sono basate su revisioni sistematiche delle migliori evidenze disponibili e su una esplicita considerazione della costo-efficacia. Quando le evidenze disponibili sono limitate, le raccomandazioni sono basate sull’esperienza del gruppo che ha prodotto la linea guida – Guideline Development Group (GDG) – e sulle norme di buona pratica clinica. I livelli di evidenza delle raccomandazioni cliniche sono indicati in corsivo tra parentesi quadre.
Le quattro aree della LG piĂą rilevanti per i non specialisti sono:
- Bisogni assistenziali dei pazienti affetti da tumori cerebrali
- Valutazione neuroriabilitativa
- Effetti avversi del trattamento
- Programma di follow-up
1. Bisogni assistenziali dei pazienti affetti da tumori cerebrali
1.1. Valutare i bisogni assistenziali complessi
I tumori cerebrali sono unici nel modo in cui condizionano l’autopercezione dei pazienti perché interferiscono con le normali funzioni cerebrali. La LG enfatizza l’importanza della valutazione dei bisogni assistenziali relativi a questo aspetto.
- Essere consapevoli che i bisogni assistenziali dei pazienti affetti da tumori cerebrali rappresentano una sfida molto ardua in quanto, insieme alla disabilitĂ fisica, il tumore e i relativi trattamenti possono condizionare:
- comportamento
- funzioni cognitive
- personalitĂ
- Discutere bisogni assistenziali e sociali con il paziente affetto da tumore cerebrale e con familiari e caregiver, se opportuno. Tenere in considerazione la complessitĂ dei potenziali bisogni assistenziali e sociali (psicologici, cognitivi, fisici, spirituali, emotivi) dei pazienti con ogni tipologia di tumore cerebrale e dei loro familiari e caregiver.
- Prevedere un tempo adeguato per discutere come il tumore cerebrale potrebbe comportare importanti cambiamenti nella vita del paziente e dei suoi familiari e caregiver per enucleare e discutere i bisogni assistenziali e sociali.
[Raccomandazioni basate su evidenze di qualitĂ da media ad elevata da studi qualitativi]
1.2. Identificare un professionista sanitario di riferimento
Considerato che coordinare questi bisogni è molto complesso, per assistere il paziente con tumore cerebrale è fondamentale individuare una persona con cui discutere le sue preoccupazioni, generalmente identificata dai centri di cure secondarie o da centri di neuroscienze di terzo livello. Assicurarsi che il nominativo di questa persona sia chiaramente visibile su ogni documento medico del paziente, anche in quelli delle cure primarie, per un miglior coordinamento e supporto dei team di cure primarie e secondarie.
- Identificare un professionista sanitario responsabile di coordinare il supporto sanitario e sociale del paziente con tumore cerebrale e dei familiari e caregiver, per esempio una figura chiave (spesso un’infermiere con specifica competenza) come definito nella LG NICE sul miglioramento degli outcome per le persone con tumore cerebrale e altri tumori del sistema nervoso centrale (4). [Raccomandazione basata su evidenze di qualità elevata da studi qualitativi]
1.3. Condividere le informazioni
Spesso i pazienti affetti da tumore cerebrale non sono soddisfatti delle modalitĂ con cui vengono loro fornite le informazioni (5). La LG riconosce la rilevanza di modalitĂ e tempi di comunicazione delle informazioni, ma chiarisce che alcune informazioni hanno un valore medico-legale rilevante e non devono essere tralasciate. Mentre gli specialisti formulano e spiegano al paziente la diagnosi e il trattamento, le figure non specialistiche spesso sono chiamate a fornire risposte sulle implicazioni per il futuro del paziente.
- Fornire informazioni al paziente affetto da tumore cerebrale e a familiari e caregiver, se opportuno:
- in maniera realistica ed empatica
- in forma adeguata (scritta e orale) (6)
- nei momenti opportuni del percorso di cura
- Fornire e spiegare i risultati clinici (es. referti dei test di imaging e di analisi istologiche) al paziente affetto da tumore cerebrale e ai suoi familiari e caregiver il prima possibile.
- Spiegare al paziente che per legge è tenuto a notificare alla Motorizzazione Civile la sua patologia e le relative implicazioni per l’autorizzazione alla guida.
[Raccomandazioni basate su evidenze di qualità da media ad elevata da studi qualitativi e sull’esperienza e l’opinione del GDG]
1.4. Valutazione neuroriabilitativa
Considerato che il NICE intende commissionare una LG sulla riabilitazione neurologica, la presente LG formula raccomandazioni solo sulla valutazione per la riabilitazione. L’invio del paziente ai servizi di neuroriabilitazione è effettuato principalmente dai professionisti dell’assistenza specialistica e ultraspecialistica, ma non sono escluse richieste in tal senso da parte di MMG e di non specialisti.
- Richiedere una valutazione neuroriabilitativa relativa allo stato fisico, cognitivo ed emotivo del paziente con tumore cerebrale al momento della diagnosi e ad ogni fase del follow-up.
- Fornire al paziente con tumore cerebrale e a familiari e caregiver, se opportuno, informazioni relative all’accesso alla riabilitazione neurologica, spiegando quali funzioni può migliorare.
- Fornire ai pazienti con tumore cerebrale e a familiari e caregiver informazioni su:
- opzioni di riabilitazione neurologica disponibili a livello locale sia in setting ospedalieri che ambulatoriali
- modalitĂ per ricevere una valutazione neuroriabilitativa.
2. Effetti avversi del trattamento
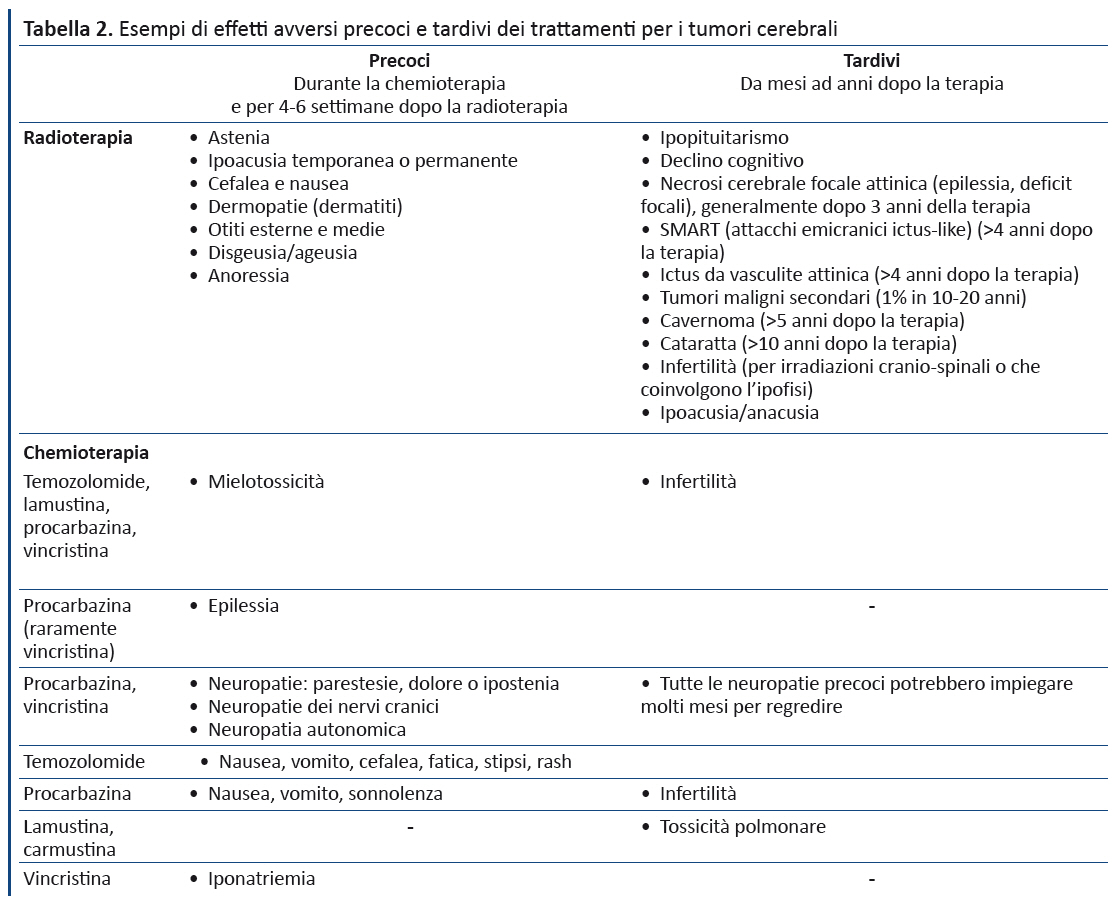
Il trattamento del tumore cerebrale può avere effetti avversi sia precoci, sia anche dopo mesi o anni. La tabella 2 riporta alcuni esempi di questi effetti tardivi, mentre il box 1 elenca le raccomandazioni formulate dal GDG per ridurre i rischi.
|
Box 1. Gestione del rischio di effetti tardivi della radioterapia
*Evento frequente se l’ipofisi è sottoposta una significativa dose di radiazioni |
- Valutare il rischio individuale del paziente di sviluppare eventi avversi a lungo termine dopo il completamento della terapia, segnalandolo sulla documentazione riassuntiva del trattamento e fornendo spiegazioni al paziente stesso e a familiari e caregiver, se opportuno. [Raccomandazioni basate sull’esperienza e l’opinione del GDG]
3. Follow-up di routine
Il GDG si è confrontato sui molteplici ruoli del follow-up, inclusi il supporto proattivo dei pazienti con tumore cerebrale e l’identificazione precoce della recidiva di malattia o di una sua progressione. Sono stati inoltre discussi i rischi relativi ad un eccesso di visite ospedaliere e di indagini strumentali.
Considerato che i programmi di follow-up sono estremamente variabili, la LG fornisce le raccomandazioni per il follow-up del glioma, delle metastasi cerebrali e dei meningiomi (box 2-4), che consentono una prima pianificazione e in particolare definire la frequenza dei test di imaging necessari per la sorveglianza.
|
Box 2. Rivalutazione clinica dei pazienti con glioma Grado I Test di imaging a 12 mesi, poi considerare:
Grado II, mutazione IDH1, 1p19q non-codelection; Grado II, 1p19q codelection; Grado III, 1p19q codelection Grado II, IDH1 wild type; Grado III, 1p19q non-codelection; Grado IV (glioblastoma) |
|
Box 3. Rivalutazione clinica dei pazienti con meningioma Grado I, non residuo tumorale
Grado I, residuo tumorale*
Grado I, dopo radioterapia
Grado II
Grado III
Meningioma asintomatico incidentale
|
|
Box 4. Rivalutazione clinica dei pazienti con metastasi cerebrali
|
La LG affronta vantaggi e svantaggi di regimi di follow-up piĂą intensivi (ad esclusione dei pazienti con sintomatologia attiva): questi sono descritti nel box 5 e possono rappresentare la base per una discussione con i pazienti sulla frequenza del follow-up.
|
Box 5. Vantaggi e svantaggi di un follow-up piĂą intenso dei pazienti con metastasi cerebrali Vantaggi
Svantaggi
|
La raccomandazione più rilevante è rivolta ai professionisti sanitari non specialisti e sottolinea come ogni cambiamento di segni o sintomi neurologici deve essere considerato come suggestivo di recidiva del tumore e richiede un contatto urgente con il centro dove il paziente è stato trattato inizialmente, o con un centro di terzo livello, se indicato:
- Effettuare una rivalutazione clinica, con test di imaging appropriati, per i pazienti con metastasi cerebrali ogni volta che sperimentano cambiamenti di segni o sintomi neurologici o ne sviluppano di nuovi. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
4. Potenziali ostacoli all’implementazione
Il GDG riconosce che i pazienti affetti da tumore cerebrale e i lungosopravviventi richiedono programmi socio-sanitari per i quali il coordinamento tra i servizi può rappresentare una rilevante criticità .
5. Raccomandazioni per la ricerca futura
Il GDG ha identificato varie aree in cui non è stato possibile formulare raccomandazioni a causa della mancanza di evidenze di elevata qualità e, pertanto, ha identificato cinque aree prioritarie per ricerca.
- L’aggiunta di temozolomide adiuvante alla radioterapia, migliora la sopravvivenza dei pazienti con glioma di II grado IDH wild type?
- Un’assistenza di supporto integrata con l’assistenza standard migliora gli outcome dei pazienti con glioma a basso grado di malignità ?
- Un accesso precoce ai servizi di cure palliative, rispetto all’assistenza oncologica standard, migliora l’outcome dei pazienti affetti da glioblastoma?
- Dopo il trattamento, la precoce identificazione delle recidive migliora la sopravvivenza e altri outcome del glioma, stratificato per indagini molecolari?
- Nel meningioma di I grado non completamente resecato la radioterapia immediata è più efficace rispetto a quella differita?
Di queste, una è particolarmente rilevante per le cure primarie: “La diagnosi precoce di recidiva dopo il trattamento migliora la sopravvivenza/esiti complessivi nel glioma, stratificato per mutazioni molecolari?” Il GDG ha deciso di dare priorità alla ricerca sul glioma in quanto rappresenta il sottotipo più frequente di tumore cerebrale primario.
Ulteriori studi sono necessari per stabilire il trade-off tra l’identificazione precoce della recidiva e i danni derivanti dall’aumento degli oneri per i pazienti e per i professionisti delle cure primarie per screening più frequenti nel caso di cambiamenti dei sintomi e segni neurologici.



