Guidelines & Standards
Evidence 2012;4(7): e1000024 doi: 10.4470/E1000024
Pubblicato: 27 novembre 2012
Copyright: Š 2012 Schulz KF et al. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente lâutilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Vedi anche: CONSORT 2010 Spiegazione ed Elaborazione
Nota dellâEditore: al fine di incoraggiare la diffusione del CONSORT Statement 2010, questo articolo - accessibile gratuitamente sul sito www.annals.org - sarĂ inoltre pubblicato su BMJ, The Lancet, Obstetrics & Gynecology, PLoS Medicine, Open Medicine, Journal of Clinical Epidemiology, BMC Medicine, e Trials. Gli autori detengono congiuntamente il copyright di questo articolo. Per dettagli sul suo utilizzo si prega di consultare il sito web del CONSORT (www.consort-statement.org).
I trial controllati randomizzati (RCT), adeguatamente disegnati, condotti e pubblicati, rappresentano il gold standard per valutare lâefficacia degli interventi sanitari. Tuttavia, i RCT che mancano di rigore metodologico possono generare risultati distorti da bias (1). Inoltre, per valutare accuratamente un trial, i lettori necessitano di informazioni complete, chiare e trasparenti su metodi e risultati. Sfortunatamente non è possibile effettuare unâadeguata valutazione critica di molti trial perchĂŠ gli autori non riportano informazioni fondamentali in maniera chiara e completa (2-4).
La mancanza di un adeguato reporting ha portato nel 1996 allo sviluppo del CONSORT (Consolidated Standards of Reporting Trials) Statement (5) e, cinque anni dopo, alla sua revisione (6-8). Se questi statement hanno migliorato la qualitĂ del reporting di alcuni RCT (9,10), numerosi report continuano ad essere inadeguati (2). Inoltre, dal 2001, anno dellâultima revisione, sono emerse sia nuove evidenze metodologiche, sia numerose esperienze pratiche. Per questo abbiamo organizzato un meeting del CONSORT Group per aggiornare lo statement del 2001 (6-8). Il presente articolo riporta il CONSORT 2010, risultato di tale revisione.
OBIETTIVO DEL CONSORT 2010
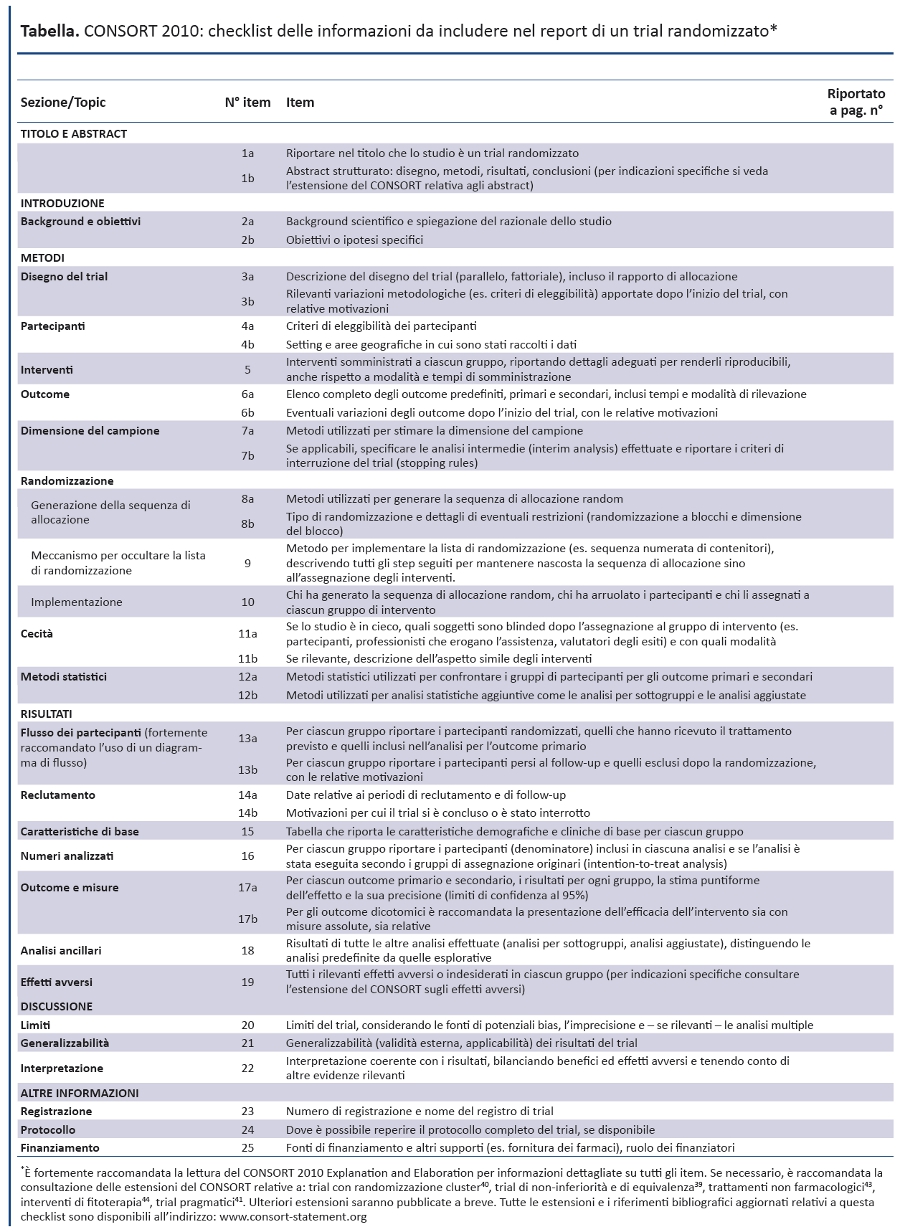
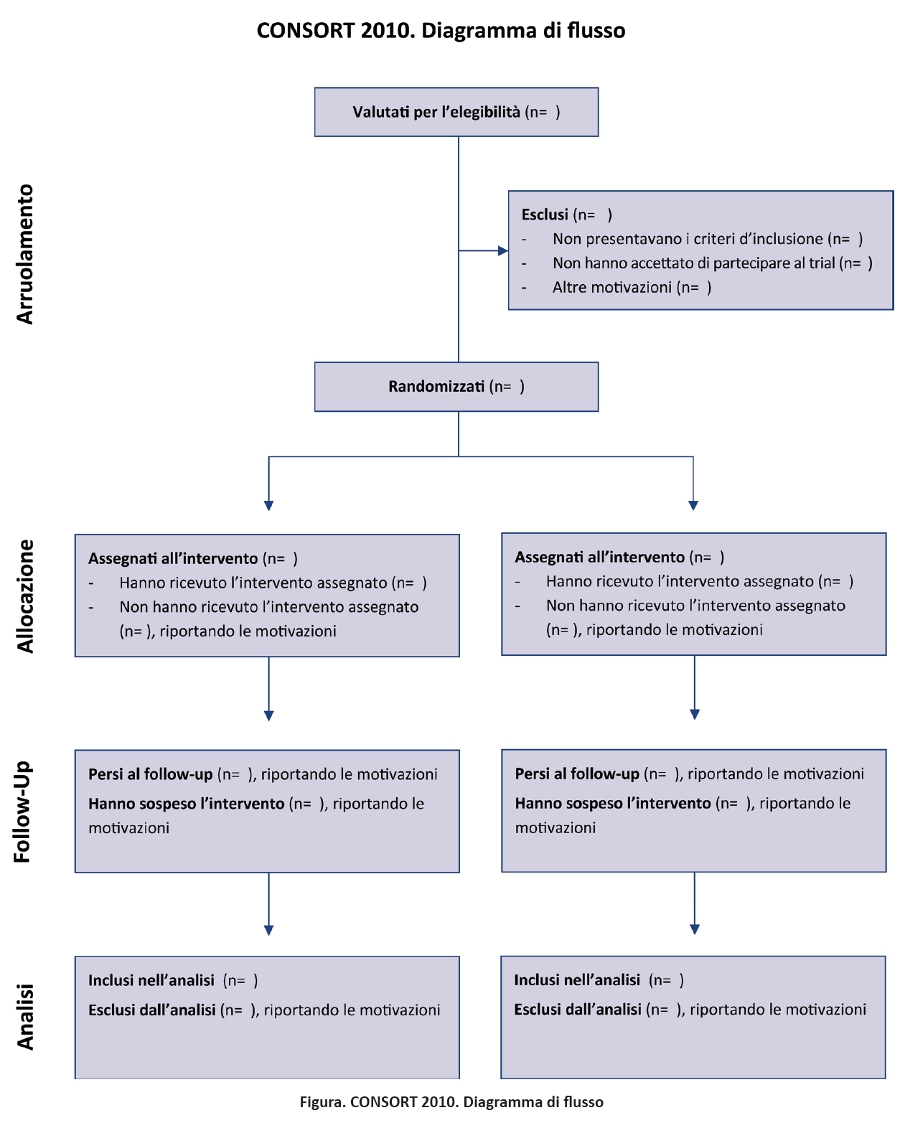
Il CONSORT Statement 2010 è costituito dal presente articolo, inclusi la checklist di 25 item (tabella) e il diagramma di flusso (figura). Il CONSORT 2010 fornisce linee guida per il reporting di tutti i trial, ma si concentra sul disegno piĂš comune: il trial randomizzato con due bracci paralleli. Altri disegni, come i trial con randomizzazione cluster e i trial di non inferioritĂ , richiedono ulteriori informazioni aggiuntive. Sul sito web ufficiale (www.consortstatement.org) sono disponibili sia specifiche estensioni del CONSORT per questi disegni (11,12), sia altre pubblicazioni CONSORT. Parallelamente al CONSORT Statement, abbiamo aggiornato lâarticolo di spiegazione ed elaborazione (13), che descrive tutti gli item della checklist, fornisce il background metodologico e riporta esempi di reporting adeguati pubblicati in letteratura. Una scrupolosa aderenza degli autori agi item della checklist favorisce la chiarezza, la completezza e la trasparenza dei report; infatti, informazioni complete, descrizioni esplicite e assenza di espressioni ambigue servono al meglio lâinteresse di tutti i lettori. Si precisa che il CONSORT Statement 2010 non include raccomandazioni per la pianificazione, la conduzione e lâanalisi dei trial, ma ha lâobiettivo di indirizzare esclusivamente il reporting: cosa è stato fatto e quali risultati sono stati ottenuti.
Ovviamente, il CONSORT influenza indirettamente anche la pianificazione e la conduzione dei trial: infatti un report trasparente rivela eventuali carenze metodologiche dello studio. Di conseguenza, i ricercatori che conducono trial metodologicamente inadeguati, dovendo redigere un report trasparente, difficilmente riusciranno ad arrivare alla pubblicazione senza che i metodi inadeguati vengano svelati dalla peer-review. Questa emergente realtà dovrebbe in futuro fornire un impulso vigoroso per una migliore pianificazione e conduzione dei trial, che rappresenta un obiettivo secondario e indiretto del nostro lavoro, visto che il CONSORT può aiutare i ricercatori a disegnare i trial.
BACKGROUND DEL CONSORT
Gli sforzi finalizzati a migliorare il reporting dei trial hanno subito unâaccelerazione intorno alla metĂ degli anni â90. Un forte stimolo è arrivato anche dalla ricerca metodologica che, oltre a rilevare che gli autori dei RCT pubblicavano report âpoveriâ di dettagli, ha dimostrato che la conduzione o il reporting inadeguato dei trial sono associati a bias14. Due iniziative mirate a sviluppare linee guida per il reporting portarono uno di noi (D.M.), insieme a Drummond Rennie, alla pubblicazione della prima versione del CONSORT Statement nel 1996 (5). La successiva ricerca metodologica su queste tematiche consolidò i risultati precedenti (15) portando nel 2001 alla prima revisione del CONSORT Statement (6-8). Successivamente, il volume crescente della ricerca metodologica ha reso necessario un ulteriore aggiornamento.
Di fatto, i membri del CONSORT Group sorvegliano continuamente la letteratura identificando le evidenze per aggiornare il CONSORT Statement: in particolare, oltre 700 studi sono archiviati nel CONSORT Evidence Database disponibile sul sito web. Gli item vengono aggiunti, eliminati o modificati in base sia a queste evidenze, sia alle raccomandazioni del CONSORT Group, un eterogeneo team internazionale di ricercatori clinici, statistici, epidemiologi e editori di riviste biomediche. Il Comitato Esecutivo (CE) del CONSORT (K.F.S., D.G.A., D.M.) mira a costituire un equilibrio tra ricercatori affermati ed emergenti al fine di rendere dinamica la composizione del CONSORT Group. Dal momento che il nostro lavoro si espande in relazione a progetti emergenti e relative competenze, invitiamo nuovi componenti a contribuire allâiniziativa. In questo modo il CONSORT integra continuamente nuove idee e prospettive, permettendo al CONSORT Statement di evolvere continuamente.
Negli anni il CONSORT ha guadagnato un notevole consenso: oltre 400 riviste in tutto il mondo, pubblicate in diverse lingue, hanno supportato direttamebte il CONSORT Statement e numerose altre riviste biomediche lo supportano a nostra insaputa. Inoltre, migliaia di riviste lo sostengono indirettamente attraverso lâapprovazione del CONSORT Statement da parte dellâInternational Committee of Medical Journal Editors (www.icmje.org). Altri importanti gruppi editoriali, quali il Council of Science Editors e la World Association of Medical Editors, sostengono ufficialmente il CONSORT. Tale sostegno appare giustificato: infatti, quando utilizzato da autori e riviste, il CONSORT sembra migliorare il reporting dei trial (9).
SVILUPPO DEL CONSORT 2010
Nel gennaio 2007 trentuno componenti del CONSORT Group si sono riuniti a Montebello (Quebec, Canada) con lâobiettivo di aggiornare il CONSORT Statement 2001. Rispetto alla versione del 2001, oltre alle evidenze metodologiche, erano emerse nuove criticitĂ . Ad alcuni componenti del gruppo è stata affidata la responsabilitĂ di sintetizzare le evidenze rilevanti su un particolare item della checklist di loro interesse. Sulla base di tali evidenze il gruppo ha definito la rilevanza di ciascun item e, analogamente alle versioni precedenti, ha mantenuto solo gli item ritenuti assolutamente indispensabili per il reporting di un RCT. Infatti, alcuni item potenzialmente rilevanti non sono stati inclusi: ad esempio, lâapprovazione da parte di un comitato etico, perchĂŠ richiesto sia dagli enti finanziatori, sia dalle istruzioni per gli autori delle riviste. Altri item rilevanti, come ad esempio lâesistenza di un monitoraggio locale, in assenza di evidenze empiriche o di un consenso generale sulla loro rilevanza, al momento non sono inclusi. Il CONSORT Statement 2010 definisce dunque i criteri minimi, ma non per questo gli autori devono astenersi dallâincludere altre informazioni se considerate rilevanti.
A seguito del meeting di Montebello, il CE del CONSORT, grazie a diverse teleconferenze e meeting, ha effettuato la revisione della checklist. In particolare, dopo 7 passaggi maggiori, una prima revisione è stata distribuita a un gruppo piĂš esteso per un feedback, a seguito del quale il CE si è riunito due volte per discutere i commenti e produrre una versione semi-definitiva. Questa ha costituito la base per la stesura della bozza di questo articolo, distribuita poi al gruppo per il feedback. Tenendo in considerazione tutti i commenti, il CE ha finalizzato lo statement e redatto una bozza del manoscritto di spiegazione ed elaborazione, con il supporto di altri membri del gruppo allargato. I contenuti del meeting CONSORT 2007 hanno fornito il materiale per lâaggionamento dellâarticolo di spiegazione ed elaborazione distribuito a tutto il gruppo per eventuali integrazioni, eliminazioni e modifiche. Il risultato finale di questo processo è il documento CONSORT 2010 Spiegazione ed Elaborazione (13).
MODIFICHE NEL CONSORT 2010
La revisione della checklist (tabella) ha comportato modifiche evolutive, senza rivoluzionare la versione prevedente, mentre il diagramma di flusso (figura) non è stato modificato, ad eccezione di un solo termine. Inoltre, considerato che le estensioni del CONSORT fanno riferimento ai numeri degli item originali, è stata mantenuta la numerazione originale, ad eccezione degli item 2 e 5. Inoltre, sono stati aggiunti ulteriori item come sotto-item di item esistenti, come item con nuovo numero in coda alla checklist, oppure come item intercalato in un segmento rinumerato (item 3). Il box 1 riporta le modifiche generali e il box 2 quelle specifiche. Sul sito del CONSORT è disponibile il testo a fronte delle versioni del 2001 e del 2010.
Box 1. Modifiche generali rilevanti nel CONSORT Statement 2010 Eâ stato semplificato il linguaggio, come negli item 1, 8, 10, 13, 15, 16, 18, 19 e 21. Eâ stata migliorata la forma, eliminando da tutti gli item della versione del 2001 il modo imperativo. Eâ stata aumentata la specificitĂ della valutazione suddividendo alcuni item in sotto-item. Numerose riviste chiedono agli autori di compilare una checklist CONSORT indicando le pagine del manoscritto dove vengono riportati i differenti item. Nellâutilizzo della checklist erano emerse difficoltĂ pratiche quando lâitem comprendeva elementi multipli, come ad esempio lâitem 4 che include lâeleggibilitĂ dei partecipanti, i setting e i luoghi della raccolta dati. Con la versione del 2001, ad esempio, un autore poteva indicare sulla checklist il numero di pagina per quellâitem pur avendo riportato nellâarticolo solo lâeleggibilitĂ , omettendo setting e luoghi. Il CONSORT 2010 riduce le ambiguitĂ e obbliga gli autori a fornire i numeri di pagina nella checklist sia per lâeleggibilitĂ che per i setting. |
|
Box 2. Rilevanti modifiche specifiche nel CONSORT Statement 2010 Item 1b (titolo e abstract). Aggiunto un sotto-item relativo a una sintesi strutturata del disegno, dei metodi, dei risultati e delle conclusioni del trial, fornendo i riferimenti allâarticolo CONSORT per gli abstract21. Item 2b (introduzione). Aggiunto un nuovo sotto-item (item 5 del CONSORT 2001) relativo a âObiettivi o ipotesi specificheâ. Item 3a (disegno del trial). Aggiunto un nuovo item che comprende questo sotto-item per specificare il disegno di base dello studio (es. a gruppi paralleli, crossover, cluster) e il rapporto di allocazione. Item 3b (disegno del trial). Aggiunto un sotto-item relativo a eventuali modifiche ai metodi dopo lâinizio del trial, riportandone le motivazioni. Item 4 (partecipanti). Item 3 del CONSORT 2001. Item 5 (interventi). Item 4 del CONSORT 2001. Incoraggiata una maggiore specificitĂ precisando che le descrizioni degli interventi devono includere âdettagli adeguati per renderli riproducibiliâ3. Item 6 (outcome). Aggiunto un sotto-item relativo allâidentificazione di eventuali modifiche alle misurazioni degli outcome (end-point) primario e secondari effettuate dopo lâinizio del trial. Questo deriva dallâevidenza che spesso gli autori analizzano e riportano outcome che non coincidono con quelli predefiniti nei protocolli, che addirittura vengono ignorati: è il fenomeno noto come reporting selettivo degli outcome4,22. Eliminato il testo sui metodi utilizzati per migliorare la qualitĂ delle misurazioni degli outcome. Item 9 (meccanismo per occultare la lista di randomizzazione). Item riformulato perchè che gli autori dovrebbero dettagliare tutti gli step realmente effettuati per garantire lâoccultamento dellâallocazione, piuttosto che riportare semplicemente in maniera imprecisa, talora banale, generiche garanzie di occultamento. Item 11 (cecitĂ ). Aggiunta la specifica delle modalitĂ di attuazione del blinding e, se rilevante, la descrizione della similaritĂ di interventi e procedure. Eliminato il testo relativo a âcome è stato valutato il successo del blindingâ, perchĂŠ mancano sia le basi teoriche, sia le evidenze empiriche per supportare la validitĂ di tali valutazioni23,24. Item 12a (metodi statistici). Aggiunto che dovrebbero essere forniti anche i metodi statistici per lâanalisi degli outcome secondari. Sotto-item 14b (reclutamento). Sulla base della ricerca empirica, è stato aggiunto un sotto-item relativo a âperchĂŠ il trial si è concluso o è stato interrottoâ25. Item 15 (caratteristiche di base). Definito esplicitamente con la dicitura âuna tabellaâ che le caratteristiche di base (demografiche, cliniche, altro) di ciascun gruppo sono piĂš chiare quando riportate in una tabella. Item 16 (numeri analizzati). Lâespressione âanalisi per intention-to-treatâ, ampiamente abusata, è stata sostituita dalla richiesta esplicita di informazioni sul fatto che i partecipanti vengano mantenuti nei loro gruppi originari di assegnazione26. Sotto-item 17b (outcome e misure). Per unâappropriata interpretazione clinica, lâesperienza ha suggerito di aggiungere âper gli outcome dicotomici è raccomandata la presentazione dellâefficacia dellâintervento sia con misure assolute, sia relativeâ27. Item 19 (effetti avversi). Incluso il riferimento allâestensione del CONSORT sugli effetti avversi28. Item 20 (limiti). Sostituisce il precedente item âInterpretazioneâ, suggerendo di segnalare le fonti di potenziali bias e imprecisioni. Item 22 (interpretazione). Sostituisce il precedente item âEvidenze complessiveâ. In veritĂ , agli autori dovrebbe essere lasciato un certo margine per interpretare il titolo vago di questo item. Tuttavia il gruppo CONSORT ha espresso la sua preoccupazione per il fatto che le conclusioni negli articoli spesso travisano i risultati delle analisi e tendono a ignorare o a minimizzare gli effetti avversi. Pertanto lâitem è stato modificato per inserire il concetto che i risultati devono corrispondere allâinterpretazione dei dati e che benefici e rischi devono essere riportati in maniera equilibrata. Item 23 (registrazione). Nuovo item sulla registrazione del trial. Evidenze empiriche sottolineano la necessitĂ di registrare i trial, e la recente richiesta del numero di registrazione da parte degli editori di riviste ha favorito la compliance29. Item 24 (protocollo). Nuovo item sullâaccessibilitĂ del protocollo del trial. Evidenze empiriche suggeriscono che, nella conduzione e reporting dei trial, spesso gli autori ignorano quanto definito nel protocollo4,22. Pertanto lâaccessibilitĂ del protocollo può favorire lâaderenza al protocollo stesso prima della pubblicazione e dopo può agevolarne la valutazione. Item 25 (finanziamento). Nuovo item sulle fonti di finanziamento. Evidenze empiriche dimostrano che talvolta le fonti di finanziamento sono associate alla stima degli effetti del trattamento in studio30. |
IMPLICAZIONI E LIMITI
Abbiamo sviluppato il CONSORT 2010 per aiutare gli autori a redigere report di RCT, gli editori e i revisori a revisionare i manoscritti per la pubblicazione e i lettori a valutare in maniera critica gli articoli pubblicati. Considerato che lâarticolo CONSORT 2010 Spiegazione ed Elaborazione chiarisce e contestualizza gli item della checklist, raccomandiamo di utilizzarlo insieme alla checklist sia per favorire un reporting completo, chiaro e trasparente, sia per facilitare la valutazione dei trial pubblicati.
Il CONSORT 2010 si concentra principalmente sui trial a due bracci paralleli, che costituiscono oltre la metĂ di quelli pubblicati in letteratura (2). Se la maggior parte degli item si applicano a tutti i trial randomizzati, alcuni tipi di trial o specifiche situazioni richiedono informazioni aggiuntive nel report. Nel dubbio, autori, editori e lettori sono invitati a consultare il sito del CONSORT per le estensioni, le espansioni, le implementazioni o altre rilevanti linee guida.
Lâapproccio evidence-based utilizzato per il CONSORT ha costituito un modello di riferimento per lo sviluppo di altre linee guida per il reporting, come quelle per le revisioni sistematiche di studi che valutano gli interventi sanitari (16), gli studi diagnostici (17) e gli studi osservazionali (18). Lâobiettivo esplicito di tutte queste iniziative è di migliorare il reporting della ricerca sanitaria. LâEQUATOR (Enhancing the Quality and Transparency of Health Research) Network ha lâobiettivo di favorire lo sviluppo e la diffusione di linee guida per il reporting: il sito www.equator-network.org fornisce informazioni su tutte le linee guida per il reporting della ricerca sanitaria.
Con il CONSORT 2010 abbiamo ribadito la necessitĂ di non realizzare una struttura rigida per il reporting dei RCT. Infatti, il progetto Standards of Reporting Trials (SORT) (19), nel tentativo di introdurre un format rigido, è risultato fallimentare in unâesperienza pilota con un editore e alcuni autori (20). Pertanto, il formato degli articoli deve rispettare lo stile della rivista, le norme editoriali, gli aspetti tradizionali dellâambito di ricerca in cui si muove e, ove possibile, le preferenze dellâautore. Non è nostra intenzione standardizzare la struttura del reporting: è sufficiente che gli autori riportino gli item richiesti della checklist in un qualunque punto dellâarticolo con dettaglio e chiarezza. Tuttavia, riteniamo utile creare sottotitoli nelle sezioni principali, in particolare in quelle dei metodi e dei risultati.
Il CONSORT sollecita la completezza, la chiarezza e la trasparenza del reporting, che ovviamente riflettono la pianificazione e la conduzione del trial. Tuttavia, quale potenziale inconveniente, una linea guida per il reporting può indurre alcuni autori a riportare informazioni fittizie, piuttosto che quanto realmente fatto. Autori, revisori ed editori dovrebbero evitare accuratamente questo inconveniente e fare riferimento, ad esempio, ai protocolli dei trial, alle informazioni disponibili nei registri di trial e nei siti web delle agenzie regolatorie. Inoltre, il CONSORT Statement 2010 non comprende raccomandazioni sulla pianificazione e conduzione dei RCT: infatti, gli item devono favorire un reporting chiaro su cosa gli autori hanno fatto e come lo hanno fatto, ma non esprimono alcun giudizio su quello che avrebbero dovuto fare e come avrebbero dovuto farlo. Pertanto il CONSORT 2010 non può essere considerato uno strumento di valutazione della qualità di un trial, nÊ è appropriato utilizzare la checklist per assegnare score di qualità .
Nonostante ciò suggeriamo ai ricercatori di iniziare i loro trial avendo giĂ in mente la pubblicazione finale. Report di scarsa qualitĂ consentono agli autori di evitare, intenzionalmente o meno, la verifica di eventuali limiti metodologici dei loro trial. In ogni caso, lâampia diffusione del CONSORT da parte di riviste e gruppi editoriali, induce gli autori a riportare in modo trasparente tutti gli aspetti rilevanti del loro trial. Le relative verifiche premiano i trial ben condotti e penalizzano quelli di scarsa qualitĂ . Pertanto i ricercatori, prima di iniziare un trial, dovrebbero conoscere le linee guida CONSORT per il reporting come stimolo ulteriore per pianificare e condurre i loro studi secondo standard rigorosi.
Il CONSORT 2010 sostituisce la versione del 2001, per cui qualsiasi supporto alla versione precedente, da parte di riviste o gruppi editoriali, si estende automaticamente alla versione del 2010, se non diversamente indicato. Le riviste che non supportano ancora il CONSORT possono farlo registrandosi sul sito del CONSORT. Le riviste che supportano il CONSORT 2010 dovrebbero citare nelle âIstruzioni per gli Autoriâ una delle versioni originali del CONSORT 2010, il documento CONSORT 2010 Spiegazione ed Elaborazione e il sito del CONSORT. Agli autori che vogliono citare il CONSORT suggeriamo di citare questa o unâaltra versione originale del CONSORT Statement 2010 pubblicata su unâaltra rivista e, se opportuno, il documento CONSORT 2010 Spiegazione ed Elaborazione (13). Tutto il materiale CONSORT è pubblicato sulle riviste biomediche e disponibilie sul sito web. Gruppi o individui che desiderano tradurre il CONSORT Statement 2010 in altre lingue sono invitati a consultare la policy ufficiale disponibile sul sito web.
Sottolineiamo che il CONSORT 2010 è una linea guida in continua evoluzione, soggetta a continue rivalutazioni e, se necessario, modifiche. Considerato che le ulteriori revisioni del CONSORT Statement, oltre alle nuove evidenze, terranno in considerazione commenti, critiche, esperienze, invitiamo i lettori a inviare i loro suggerimenti attraverso il sito del CONSORT.



