Conference Report
Evidence 2017;9(9): e1000171 doi: 10.4470/E1000171
Pubblicato: 12 novembre 2017
Copyright: © 2017 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
25 anni dopo la nascita dell’Evidence-based Medicine (EBM) (1), nonostante i numerosi e rilevanti progressi (2), le critiche nei confronti del movimento non accennano a placarsi. L’EBM viene infatti “accusata” di concentrarsi sui benefici degli interventi sanitari sottostimando gli eventi avversi, di fornire solo risultati medi ignorando l’estrema variabilità del paziente individuale, di trascurare la relazione medico-paziente e il giudizio clinico, di essere influenzata da fenomeni corruttivi e conflitti di interesse (3). In realtà , l’EBM oggi sta pagando il prezzo del suo successo in quanto viene spesso manipolata e sfruttata per obiettivi meno nobili con conseguente perdita della sua reputazione (3).
Fortunatamente la comunità scientifica ha progressivamente spostato il dibattito dalle generiche e sterili critiche al movimento dell’EBM, alle reali problematiche che condizionano produzione, sintesi e trasferimento delle evidenze alla pratica professionale e all’organizzazione dei servizi sanitari (4,5). In particolare, la ricerca metodologica ha dimostrato che i processi di produzione, sintesi e utilizzo delle evidenze, oltre a presentare numerose criticità , sono scarsamente armonizzati, dimostrando che il vero problema non è la crisi dell’EBM sbandierata dai numerosi detrattori del movimento. Infatti, accanto alla inutile e costosa duplicazione sia di studi primari che secondari – revisioni sistematiche (RS) e linee guida (LG) – persistono ampie zone grigie (evidenze assenti, frammentate e/o contrastanti) che impediscono di raccomandare, o meno, un intervento sanitario. Inoltre, consistenti gap tra ricerca e pratica determinano al tempo stesso esiti di salute sub-ottimali e sprechi da sovra- e sotto-utilizzo di farmaci, dispositivi, test diagnostici e altri interventi sanitari.
In occasione della 8ª EBHC International Conference (6) la Fondazione GIMBE ha proposto l’innovativo approccio dell’ecosistema delle evidenze scientifiche, che prende spunto dalla definizione di ecosistema naturale, ovvero una comunitĂ di organismi viventi con le loro sinergie e competizioni insieme a componenti non viventi (aria, acqua, minerali, etc.) che caratterizzano l’ambiente dei vari ecosistemi presenti in natura.
Secondo la definizione proposta da GIMBE l’ecosistema delle evidenze è costituito da:
- Organismi viventi, ovvero gli innumerevoli stakeholders che popolano il mondo della sanitĂ e della ricerca con le loro competizioni, collaborazioni e conflitti di interesse (figura 1).
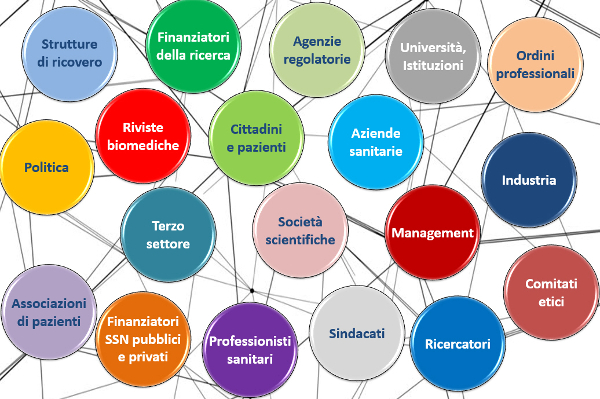
- Ambiente, ovvero le determinanti sociali, culturali economiche e politiche che caratterizzano i vari contesti.
- Componente non vivente, ovvero le evidenze scientifiche condizionate da articolati processi di produzione, sintesi e integrazione nelle decisioni professionali, manageriali e di politica sanitaria, oltre che nelle scelte di cittadini e pazienti (figura 2).
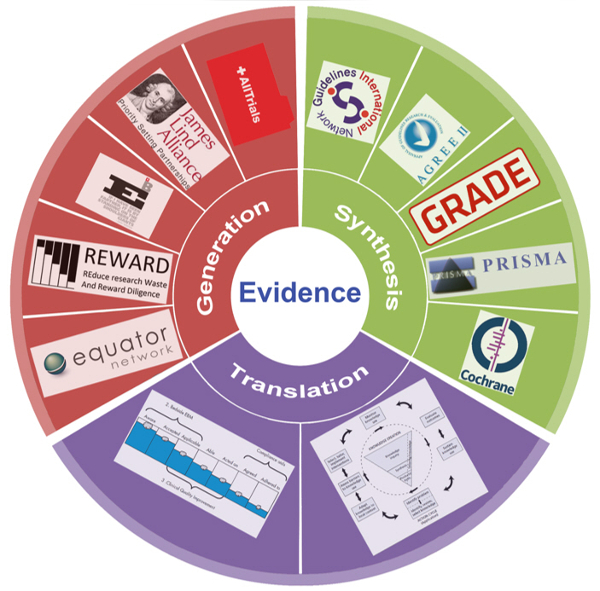
La Fondazione GIMBE, previa analisi dei punti di forza e di debolezza che oggi caratterizzano la produzione (box 1), la sintesi (box 2) e l’implementazione (box 3) delle evidenze scientifiche, ha formulato dettagliate proposte per la comunità scientifica internazionale.
|
Box 1. Evidence generation Punti di forza
Punti di debolezza
|
|
Box 2. Evidence synthesis REVISIONI SISTEMATICHE (RS)
Punti di debolezza
LINEE GUIDA (LG)
Punti di debolezza (36,37,38)
|
|
Box 3. Evidence translation Punti di forza
Punti di debolezza (46)
|
Evidence generation. Per aumentare il value e ridurre gli sprechi della ricerca biomedica la Fondazione GIMBE ha suggerito la pubblicazione di ulteriori linee guida per il reporting dei protocolli, in particolare per gli studi osservazionali e di accuratezza diagnostica. L’attenzione è stata poi rivolta alla necessità di produrre evidenze sull’impatto delle linee guida per il reporting e di estendere lo statement OMS e le policy dell’ICMJE sulla registrazione dei trial clinici agli studi osservazionali. Ancora, l’invito ad esplorare strategie per ridurre l’estrema frammentazione degli aspetti regolatori della ricerca e mettere in pratica tutte le opportunità per aumentare la riproducibilità della ricerca biomedica. Infine, per raggiungere l’obiettivo “meno pubblicazioni, più evidenze di elevata qualità ”, è indispensabile cambiare le modalità per misurare l’impatto della ricerca biomedica e i relativo meccanismi di finanziamento (47,48), aumentare l’efficienza della ricerca di base e raggiungere un ottimale equilibrio tra ricerca di base, traslazionale, clinica e organizzativa.
Evidence synthesis. Rispetto alla produzione di RS servono nuove policy internazionali per far convergere gli sforzi sulle Cochrane reviews, riducendo al tempo stesso la proliferazione di RS irrilevanti. GIMBE ha suggerito all’ICMJE di rendere obbligatorio per la pubblicazione delle RS il numero di registrazione PROSPERO (49), analogamente a quanto previsto per i trial clinici; in secondo luogo, l’ICMJE dovrebbe incoraggiare la produzione di Cochrane reviews consentendo agli autori di pubblicare una sintesi nelle riviste affiliate all’ICMJE; infine, è indispensabile un database unico per le RS di elevata qualità . Relativamente alla produzione di LG è stata enfatizzata la necessità di una governance internazionale per evitare la proliferazione di LG di bassa qualità ; l’opportunità di migliorare la gestione dei conflitti di interesse utilizzando gli standard del G-I-N (39); la necessità di includere la multimorbidità (43) nelle raccomandazioni delle LG e di migliorare l’utilizzabilità delle LG in particolare integrando le raccomandazioni in sistemi informatizzati di supporto alle decisioni cliniche (50). Infine, l’esigenza di un database centralizzato di LG che permetta di filtrare la loro ricerca secondo criteri di qualità internazionali (AGREE II, G-I-N, Institute of Medicine).
Evidence translation. GIMBE ha rilevato innanzitutto che servono più evidenze di buona qualità su trasferimento delle evidenze, processo decisionale condiviso, compliance del paziente. Inoltre, è necessario definire standard internazionali per definire priorità a livello locale, sviluppare PDTA attraverso l’adattamento locale di LG e identificare ostacoli e fattori facilitanti finalizzati alla elaborazione di adeguate strategie multifattoriali di implementazione. Rispetto alla valutazione dell’impatto del trasferimento delle evidenze, la misurazione delle performance deve sempre utilizzare affidabili indicatori di processo e di esito e, soprattutto, allinearli insieme ai relativi sistemi premianti attraverso i vari livelli: dal singolo professionista al team, all’organizzazione sanitaria, sino all’intero sistema sanitario regionale e quindi nazionale. Ovviamente, è indispensabile aumentare l’alfabetizzazione di cittadini e pazienti sull’efficacia, appropriatezza e sicurezza degli interventi sanitari, al fine di ridurre le loro aspettative per una medicina mitica e una sanità infallibile.
Infine, le dinamiche che regolano il complesso ecosistema delle evidenze devono passare dall’approccio unidirezionale (produzione ? sintesi ? trasferimento) a quello multidirezionale (figura 3), dove la sintesi delle evidenze, tramite RS, deve sempre informare la decisione di condurre nuovi studi primari, oltre che interpretarli alla luce delle conoscenze già disponibili. Ma ancor di più, il trasferimento delle evidenze deve sempre informare la loro produzione e sintesi, attraverso virtuosi programmi di ricerca e sviluppo. Infatti, in un momento storico caratterizzato dalla crisi di sostenibilità di tutti i sistemi sanitari, è tempo di finanziare la ricerca comparativa indipendente in grado di fornire adeguate evidenze e di non rimborsare più con il denaro pubblico interventi sanitari di efficacia non documentata.
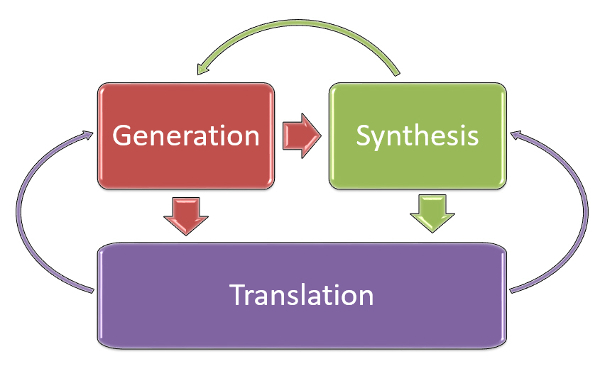
|
8th International Conference for Evidence-based Health Care Teachers and Developers Nella magica atmosfera di Taormina la Fondazione GIMBE ha ospitato l’ottava edizione della International Conference for Evidence-based Health Care (EBHC) Teachers and Developers, che ha messo a confronto oltre 150 professionisti provenienti da 24 paesi di tutti i continenti sul rivoluzionario concetto di “ecosistema delle evidenze scientifiche” presentato in esclusiva in questo servizio. In particolare, Nino Cartabellotta (Fondazione GIMBE) ha posto l’enfasi sulla necessità di migliorare ed integrare produzione, sintesi e trasferimento delle evidenze alle pratiche professionali, all’organizzazione dei servizi sanitari e alle politiche sanitarie, tenendo conto del contesto (sociale, culturale, economico e politico) e di competizioni, collaborazioni e conflitti di interesse degli innumerevoli stakeholders che popolano il mondo della ricerca e della sanità . La conferenza è stata illuminata dalle relazioni di leader mondiali nell’ambito dell’EBHC. John Ioannidis (Stanford University, USA) ha spiegato perché oggi ci troviamo di fronte a un sistema “malato” che genera troppe pubblicazioni e poche evidenze scientifiche utili a migliorare la salute delle persone. Paul Glasziou (Bond University, Australia) ha illustrato la necessità aumentare il value e ridurre gli sprechi della ricerca biomedica, grazie alle raccomandazioni della campagna REWARD, già lanciata in Italia dalla Fondazione GIMBE. Douglas Altman (University of Oxford, UK) ha enfatizzato la necessità di un reporting completo e trasparente della ricerca e presentato l’EQUATOR Network, banca dati internazionale di linee guida per il reporting. Howard Bauchner (editor di JAMA) ha focalizzato ruolo e responsabilità delle riviste biomediche nel garantire qualità e trasparenza della ricerca pubblicata. Walter Ricciardi (Presidente Istituto Superiore di Sanità ) si è soffermato sulle difficoltà di integrare le migliori evidenze nelle decisioni di politica sanitaria e sulla necessità di utilizzare nuove modalità per comunicare la scienza al mondo della politica. David Tovey (editor della Cochrane Library) ha riportato le innovazioni utilizzate dalla Cochrane Collaboration nella produzione delle revisioni sistematiche, una scienza in evoluzione continua. Gordon Guyatt (McMaster University, Canada) ha illustrato le innovazioni metodologiche più recenti del metodo GRADE, utilizzato da oltre 100 organizzazioni in tutto il mondo per produrre raccomandazioni cliniche. Amir Qaseem (American College of Physicians, USA) ha descritto l’impegno del Guidelines International Network (G-I-N) nel definire standard internazionali per la produzione di linee guida affidabili e trasparenti attraverso una metodologia rigorosa e un’adeguata governance dei conflitti di interesse. Trisha Greenhalgh (University of Oxford, UK) ha affrontato le complessità dell’applicazione delle evidenze al singolo paziente nel rispetto delle sue preferenze, valori e aspettative. Angela Coulter (University of Oxford, UK) ha approfondito le modalità per coinvolgere attivamente i pazienti nella produzione e utilizzo delle evidenze scientifiche. Per Vandvik (University of Oslo, Norvegia) ha analizzato pro e contro dei sistemi digitali per accedere e orientarsi nel complesso ecosistema delle evidenze. Tutte le presentazioni sono disponibili a: www.ebhc.org |



