Conference Report
Evidence 2014;6(11): e1000092 doi: 10.4470/E1000092
Pubblicato: 19 novembre 2014
Copyright: © 2014 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
|
Sperimentazioni cliniche: nuove sfide per i comitati etici Bologna, 7 novembre 2014 Oltre 100 rappresentanti di 65 comitati etici provenienti da 16 regioni hanno partecipato alla convention nazionale, organizzata e interamente sostenuta dalla Fondazione GIMBE. Nella lettura inaugurale Nino Cartabellotta ha dimostrato che l’evoluzione delle conoscenze sull’efficacia delle terapie è condizionata negativamente da sprechi di risorse che affliggono i processi attraverso cui la ricerca viene commissionata, pianificata, condotta, analizzata, normata, gestita, disseminata e pubblicata. Silvio Garattini, Paola Mosconi e Marco Bobbio hanno ribadito la necessità di riallineare i legittimi interessi dell’industria ai bisogni di cittadini e pazienti, grazie anche al loro coinvolgimento attivo nel definire le priorità della ricerca e rigorose policy sui conflitti di interesse. Nicola Montanaro e Aldo Maggioni hanno approfondito il tema della ricerca no-profit, sottolineando la carenza di risorse dedicate nel nostro Paese, ma anche la necessità di nuovi impulsi normativi. L’Agenzia Italiana del Farmaco, con gli interventi di Donatella Gramaglia e Paola Aita, ha illustrato il nuovo regolamento europeo sulla sperimentazione clinica di medicinali e presentato la nuova piattaforma dell’Osservatorio Nazionale sulla Sperimentazione Clinica dei medicinali. Nel corso della convention i partecipanti hanno risposto a una survey con televoter su vari aspetti relativi alla gestione delle sperimentazioni cliniche da parte dei comitati etici (appendice). Il report integrale è disponibile a: www.gimbe.org/comitati-etici-2014 |
Greenhalg et coll (1). hanno recentemente decretato la “crisi” dell’Evidence-based Medicine (EBM) che, concentrandosi eccessivamente su aspetti statistici e metodologici, ha perso di vista il suo vero obiettivo: migliorare la salute delle persone e ottimizzare l’utilizzo delle risorse grazie a un’adeguata integrazione delle migliori evidenze in tutte le decisioni professionali, manageriali e di politica sanitaria. Gli autori, tuttavia, non vanno alla radice del problema: infatti, i veri limiti dell’EBM discendono dall’articolato processo con cui la ricerca viene finanziata, prodotta e pubblicata generando le evidenze su cui basare la medicina e l’assistenza sanitaria (2). Oggi, infatti, la ricerca biomedica è afflitta da un fenomeno imbarazzante e sempre più diffuso: numerose scoperte inizialmente promettenti non determinano alcun miglioramento nell’assistenza sanitaria, perché solo raramente la ricerca concretizza evidenze robuste e affidabili (3,4).
Recentemente, la prestigiosa rivista The Lancet, con la serie Research: increasing value, reducing waste, ha analizzato questo allarmante fenomeno concludendo che la maggior parte delle risorse investite nella ricerca non migliora l’assistenza sanitaria né la salute delle popolazioni, perché il sistema attuale genera ingenti sprechi a 5 livelli: la definizione delle priorità della ricerca (5), le metodologie di pianificazione, conduzione e analisi statistica (6), il processo di gestione e regolamentazione della ricerca (7), l’accessibilità a tutti i dati raccolti dalla ricerca (8) e la reale utilizzabilità dei risultati (9).
Rilevanza. Oggi le priorità della ricerca non sono definite in relazione alla rilevanza dei quesiti per migliorare la salute di cittadini e pazienti: considerato che l’agenda della ricerca è in larga parte dettata dall’industria farmaceutica e tecnologica, vengono infatti trascurate numerose priorità rilevanti di salute, in particolare relative all’efficacia di interventi sanitari non farmacologici. Inoltre, outcome rilevanti per i pazienti spesso non vengono misurati nelle sperimentazioni cliniche; infine, solo raramente i trial fanno riferimento a una revisione sistematica delle conoscenze disponibili per giustificare la reale necessità dello studio. La rilevanza della ricerca pianificata è strettamente legata al coinvolgimento di cittadini e pazienti nel definire le priorità della ricerca, oltre che gli outcome per loro rilevanti, ma soprattutto alla disponibilità di risorse pubbliche che in Italia, oltre a essere esigue, vengono prevalentemente destinate alla ricerca di base, piuttosto che a quella clinica o alla health service research.
Metodologia. Il disegno dello studio, i metodi e le analisi statistiche nelle sperimentazioni cliniche sono spesso inadeguati e in oltre il 50% degli studi mancano misure adeguate per ridurre i bias; inoltre, un numero troppo elevato di trial clinici ha una potenza statistica insufficiente. Questi limiti sono ulteriormente aggravati dal fatto che la maggior parte degli effetti terapeutici sono modesti e difficilmente distinguibili dai bias.
Regolamentazione. I processi di regolamentazione e gestione della ricerca non sono efficienti, sia perché gravosi e sproporzionati rispetto ai rischi reali per i pazienti, sia per le numerose corresponsabilità con altre fonti di sprechi e inefficienze: in particolare, per l’incapacità a mettere in atto sia filtri più rigorosi per i protocolli clinicamente irrilevanti (rilevanza) o dal disegno inadeguato (metodologia), sia azioni concrete per garantire la pubblicazione di tutti gli studi (accessibilità ).
Accessibilità . I dati della ricerca oggi non sono completamente accessibili: consistenti evidenze dimostrano che almeno la metà dei trial clinici non è mai stato registrato e che il 50% di quelli registrati non sono mai stati pubblicati. Questo inaccettabile fenomeno, che riguarda prevalentemente gli studi con risultati negativi, determina inevitabilmente una sovrastima dell’efficacia dei trattamenti.
Usabilità . I report della ricerca spesso non sono utilizzabili e frequentemente mancano di numerose informazioni. Oltre al mancato reporting di oltre il 50% degli outcome definiti nel protocollo, le modalità di “somministrazione” degli interventi terapeutici sono inadeguatamente descritti in oltre il 30% dei casi; inoltre risultati dei trial clinici non vengono discussi alla luce delle conoscenze già disponibili, per cui non risulta chiaro cosa il nuovo studio aggiunge rispetto a quanto già noto.
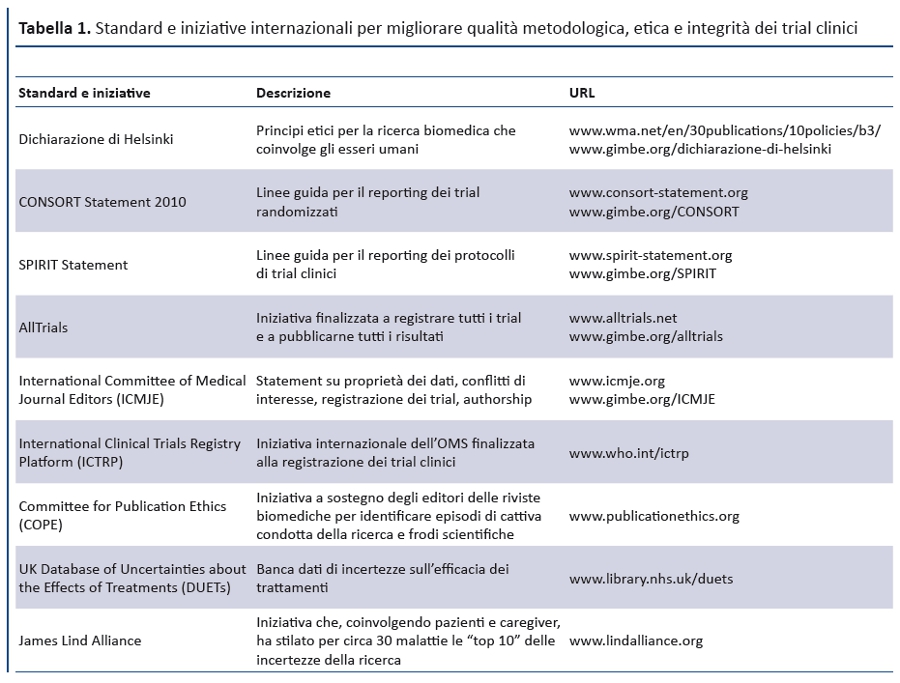
A fronte di queste criticità , gli autori dei 5 articoli della serie hanno formulato specifiche raccomandazioni per incrementare il valore e ridurre gli sprechi della ricerca, così da permettere a tutti gli stakeholders di misurare i risultati con adeguati indicatori. In particolare, la serie di The Lancet riporta iniziative e strumenti che hanno recentemente trovato una favorevole convergenza per migliorare metodologia, etica, integrità , rilevanza e valore sociale della ricerca: la Dichiarazione di Helsinki, i reporting statement (CONSORT per i trial clinici e SPIRIT per i protocolli di trial), l’iniziativa AllTrials (box 1) che richiede di registrare tutti i trial clinici e riportarne tutti i risultati, gli statement dell’International Committee of Medical Journal Editors (proprietà dei dati, conflitti di interesse, registrazione dei trial, authorship), il Committee for Publication Ethics (COPE) che supporta gli editori delle riviste nell’identificare episodi di cattiva condotta e frodi scientifiche. Molti di questi strumenti, grazie all’impegno della Fondazione GIMBE (10), sono oggi disponibili in lingua italiana (tabella 1).
|
Box 1. L’iniziativa AllTrials
|
Oggi l’intero processo di regolamentazione della ricerca si dibatte in un paradosso inaccettabile: se da un lato è sproporzionato rispetto ai rischi reali per i pazienti, scoraggiando ricercatori e sponsor e riducendo il numero di trial approvati in Italia, dall’altro compromette gli interessi dei pazienti, sia perché da il via libera a protocolli irrilevanti o dal disegno inadeguato, sia perché non è in grado di mettere in atto azioni concrete per garantire la pubblicazione dei risultati. Di conseguenza, i comitati etici italiani, indiscussi protagonisti del processo di regolamentazione, oltre a governare i “tradizionali” aspetti etici della ricerca (consenso informato, privacy, convenzione economica, fattibilità locale, etc.), devono introdurre in maniera sistematica nel processo di valutazione dei protocolli dei trial clinici gli standard internazionali validati.
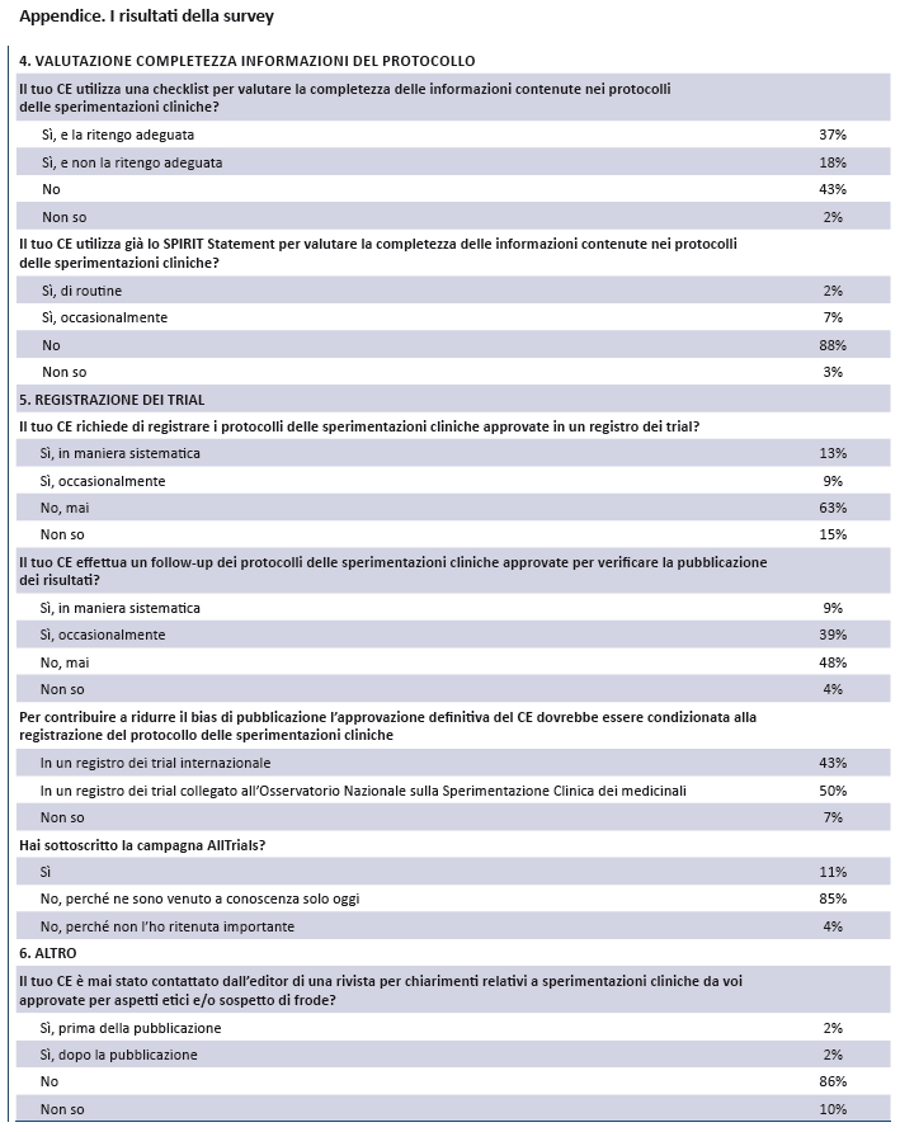
Dalla survey anonima effettuata durante la convention (appendice) sono emerse alcune criticitĂ rilevanti nelle conoscenze e nelle attivitĂ dei comitati etici italiani.
- Rispetto alla necessitĂ del coinvolgimento di rappresentanti di cittadini e pazienti nella valutazione del protocollo di una sperimentazione clinica, solo il 39% ritiene che possa migliorare la rilevanza del quesito di ricerca, ma quasi la metĂ ritiene che i rappresentanti di cittadini e pazienti non hanno ancora adeguate competenze per queste valutazioni.
- Solo il 18% non approva protocolli di sperimentazioni cliniche in cui lo sponsor mantiene la proprietĂ dei dati.
- Oltre l’80% richiede obbligatoriamente la disclosure sui conflitti di interesse del principal investigator.
- Il 44% non accerta formalmente l’aderenza dei protocolli di trial alla Dichiarazione di Helsinki, in quanto la ritiene “scontata”.
- Solo il 7% ritiene eccessivo il numero di sperimentazioni cliniche verso placebo, rispetto ai “margini” definiti dalla Dichiarazione di Helsinki.
- Solo il 37% è soddisfatto della propria checklist per valutare la completezza delle informazioni contenute nei protocolli delle sperimentazioni cliniche, ma quasi il 90% non conosce lo SPIRIT Statement.
- Rispetto alla registrazione dei trial emerge in maniera molto netta la limitata consapevolezza dei comitati etici: innanzitutto, l’85% non conosceva l’iniziativa AllTrials; in secondo luogo solo il 13% richiede di registrare i protocolli delle sperimentazioni cliniche approvate in un registro dei trial; infine, solo il 9% effettua un follow-up sistematico dei protocolli delle sperimentazioni cliniche approvate per verificare la pubblicazione dei risultati.
Considerato che uno degli obiettivi istituzionali della Fondazione GIMBE è quello di migliorare qualità metodologica, etica, integrità , rilevanza clinica e valore sociale della ricerca sanitaria, sono state avanzate tre proposte concrete per una maggiore tutela dei partecipanti alle sperimentazioni cliniche:
- Utilizzare lo SPIRIT Statement, per valutare la completezza delle informazioni contenute nei protocolli delle sperimentazioni cliniche, in particolare quelle relative ad aspetti metodologici la cui carenza influenza negativamente la qualitĂ della ricerca sperimentale.
- Approvare definitivamente le sperimentazioni cliniche solo dopo la registrazione in uno dei registri primari dell’International Clinical Trials Registry Platform, iniziativa dell’Organizzazione Mondiale della Sanità , secondo la quale “la registrazione di tutte le sperimentazioni cliniche è una responsabilità scientifica, etica e morale”.
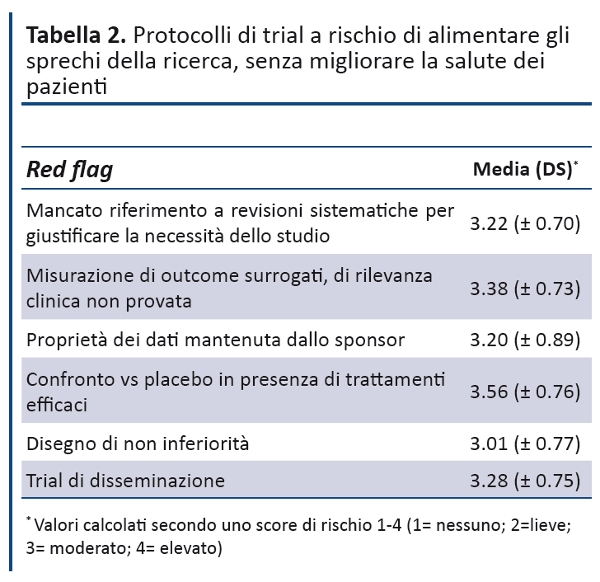
- Identificare precocemente e valutare con estrema cautela i protocolli di sperimentazioni cliniche potenzialmente irrilevanti per il progresso delle conoscenze, ma che rischiano di danneggiare i pazienti e alimentare gli sprechi della ricerca. A tal proposito, la Fondazione GIMBE ha stilato un elenco di segnali di allarme (red flags)che hanno trovato un ampio consenso tra i rappresentanti dei comitati etici presenti alla convention (tabella 2): il mancato riferimento a revisioni sistematiche delle conoscenze disponibili per giustificare la necessità del nuovo studio; l’esclusiva valutazione di outcome surrogati di rilevanza clinica non provata; lo sponsor che mantiene la proprietà dei dati e/o non consente l’accesso ai dati; il confronto verso placebo in presenza di trattamenti efficaci; i trial con disegno di non inferiorità ; i trial di disseminazione (box 2).
|
Box 2. Seeding trials: un raffinato strumento di marketing
|
Il messaggio conclusivo della convention è stato lanciato alla politica: se oltre il 25% degli sprechi in sanità consegue alla prescrizione/erogazione di interventi sanitari inefficaci e inappropriati (11), perché il SSN preferisce introdurre continuamente sul mercato trattamenti di efficacia non ancora provata piuttosto che investire in ricerca comparativa indipendente, in grado di generare conoscenze utili a ridurre gli sprechi? La proposta della Fondazione GIMBE è quella di destinare alla ricerca sull’efficacia comparativa degli interventi sanitari l’1% del fondo sanitario nazionale, perché senza ricerca in grado di produrre conoscenze rilevanti e immediatamente applicabili non può esserci sostenibilità per il Servizio Sanitario Nazionale.
Appendice. I risultati della survey. Parte I