Best practice
Evidence 2019;11(10): e1000203 doi: 10.4470/E1000203
Pubblicato: 28 novembre 2019
Copyright: © 2019 Fondazione GIMBE Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Nel Regno Unito 1.300.000 persone convivono con una diagnosi di broncopneumopatia cronica ostruttiva (BPCO), condizione associata ad una considerevole morbilità e mortalità (1), oltre che causa frequente di ricovero ospedaliero. Il servizio sanitario nazionale inglese ha riconosciuto la BPCO come area di intervento prioritario nel NHS Long Term Plan (2), anche se l’audit condotto dal Royal College of Physicians (3) identifica alcune gravi carenze: limitata possibilità di offrire la riabilitazione polmonare, insufficiente copertura della vaccinazione antinfluenzale, inadeguato trattamento e supporto per la disassuefazione al fumo.
Questo articolo sintetizza le più recenti raccomandazioni del National Institute for Health and Care Excellence(NICE) (4). Gli aggiornamenti riguardano principalmente la gestione della BPCO stabile e includono il self management e l’educazione del paziente, le procedure di valutazione per la riduzione del volume polmonare e l’ossigenoterapia domiciliare. Considerato che percorsi assistenziali efficaci per gestire la BPCO richiedono un approccio integrato tra cure primarie e secondarie e il coinvolgimento di un team multidisciplinare, le LG si concentrano sulla necessità di garantire la qualità dell’assistenza in qualsiasi setting venga preso in carico il paziente. L’assistenza specialistica, erogata in ospedale o a livello ambulatoriale, può essere indicata per soggetti con BPCO insorta in giovane età o per coloro che presentano una rapida progressione di malattia, frequenti riesacerbazioni, multimorbidità , ipossiemia o per valutare le procedure necessarie per la riduzione di volume polmonare.
Le raccomandazioni del NICE sono basate su revisioni sistematiche delle migliori evidenze disponibili e su una esplicita considerazione della costo-efficacia. Quando le evidenze disponibili sono limitate, le raccomandazioni sono basate sull’esperienza del gruppo che ha prodotto la linea guida — Guideline Development Group (GDG) – e sulle norme di buona pratica clinica. Le raccomandazioni cliniche sono contrassegnate da punti elenco, con i livelli di evidenza indicati in corsivo tra parentesi quadre. Per le raccomandazioni precedenti non sono riportati i livelli di evidenza perchĂ© al momento della loro formulazione sono stati utilizzati criteri differenti per valutarne la qualitĂ .
1. Diagnosi
La LG raccomanda di considerare una possibile diagnosi di BPCO in qualsiasi persona con dispnea, tosse, produzione cronica di espettorato e fattori di rischio come una storia di fumo di tabacco o un lavoro con esposizione a fumo, polveri o irritanti chimici. La diagnosi dipende dalla presenza di ostruzione al flusso espiratorio non reversibile, misurata con la spirometria. Un rapporto FEV1/FVC <0,7 indica di solito ostruzione al flusso aereo: tuttavia, considerato che questo valore fisso può portare ad una sovra-diagnosi negli anziani e ad una sotto-diagnosi nei più giovani, è sempre importante una sua correlazione con sintomi e segni clinici.
L’utilizzo di score prognostici compositi per la BPCO non è più raccomandato; al contrario devono essere considerati fattori di rischio individuali in grado di influenzare la prognosi a lungo termine (box 1).
|
Box 1. Fattori prognostici nella BPCO
a MRC: Medical Research Council |
Nei pazienti con BPCO è sempre più frequente riscontrare alterazioni polmonari con i test di imaging. In questi casi le nuove raccomandazioni suggeriscono una rivalutazione respiratoria del paziente nell’ambito delle cure primarie per identificare sintomi, effettuare una spirometria e, se appropriato, fornire trattamento e supporto per smettere di fumare.
2. Aspetti fondamentali del trattamento della BPCO
Durante il processo di aggiornamento sono stati identificati i cinque ”pilastri” della terapia per la BPCO, ovvero gli interventi e le terapie più rilevanti tenendo conto del loro elevato value (5) (box 2).
|
Box 2. I cinque “pilastri” della terapia per la BPCO
Questi elementi devono essere presi in considerazione ad ogni visita di controllo ed offerti a tutti i pazienti, se necessario. |
3. Educazione del paziente e self management
La LG sottolinea l’importanza di fornire al paziente con BPCO, oltre che a familiari e caregiver, informazioni relative a vari aspetti (box 3), perchè alcune evidenze dimostrano che i programmi di self management migliorano la qualità della vita e riducono il numero delle ospedalizzazioni, soprattutto se includono un piano di azione personalizzato per gestire le riesacerbazioni.
|
Box 3. Informazioni al paziente con BPCO Al momento della diagnosi e ad ogni visita di controllo fornire ai pazienti con BPCO e ai loro familiari e caregiver, se appropriato:
Set minimo di informazioni
|
- Nell’ambito del piano di azione per le riesacerbazioni, prescrivere un breve ciclo (5 giorni) di steroidi e antibiotici da assumere a domicilio se il paziente:
- ha avuto una riesacerbazione nell’ultimo anno ed è a rischio di riesacerbazione
- è in grado di comprendere rischi e benefici di questi farmaci, oltre che tempi e modalità di assunzione
- è in grado di riferire al medico di aver assunto i farmaci e chiedere una nuova prescrizione
- Negli episodi di riesacerbazione acuta di BPCO prescrivere per via orale un ciclo di 5 giorni di antibiotici (se indicato) e di prednisone 30 mg per via orale. Prima della prescrizione antibiotica considerare fattori riportati nel box 4. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
|
Box 4. Terapia delle riesacerbazioni nei pazienti con BPCO (6)
|
- Ad ogni visita di controllo, valutare con i pazienti che assumono steroidi ed antibiotici a domicilio che siano ancora in grado di comprendere come utilizzarli. Per coloro che hanno effettuato ≥3 cicli di steroidi e/o antibiotici nell’ultimo anno indagarne le motivazioni. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
- Chiedere ai pazienti con BPCO se in caso di dispnea hanno paura. In caso affermativo includere nel piano di self management interventi cognitivo-comportamentali, per aiutarli a gestire l’ansia e al tempo stesso controllare la dispnea. [Raccomandazione basata su evidenze di qualità da bassa ad alta da trial randomizzati controllati]
- In caso di eccessiva produzione di espettorato insegnare ai pazienti come:
- usare i dispositivi a pressione espiratoria positiva
- attivare ciclicamente tecniche di respirazione
- Spiegare ai pazienti a rischio di ospedalizzazione e ai loro familiari e caregiver, se appropriato, cosa aspettarsi in caso di ricovero: es. ventilazione non-invasiva e condivisione delle eventuali preferenze terapeutiche per il futuro, incluse le manovre rianimatorie e l’intensità degli interventi sanitari. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
4. Identificare e gestire l’ansia e la depressione
- Valutare se i pazienti con BPCO presentano ansia o depressione in particolare se:
- manifestano dispnea severa e/o ipossiemia
- sono stati visitati o ricoverati in ospedale per una riesacerbazione di BPCO
5. Monitoraggio della BPCO tramite telemedicina
- Nella gestione dei pazienti stabili con BPCO non prescrivere un monitoraggio di routine dei parametri fisiologici tramite telemedicina poiché non migliora la qualità di vita, non riduce i ricoveri ospedalieri e aumenta i costi. [Raccomandazione basata su evidenze di qualità da bassa ad alta da trial randomizzati controllati e su evidenze di economia sanitaria direttamente applicabili]
6. Terapie inalatorie
Durante il processo di aggiornamento è stato sviluppato un nuovo algoritmo per l’uso di farmaci inalatori (figura 1).
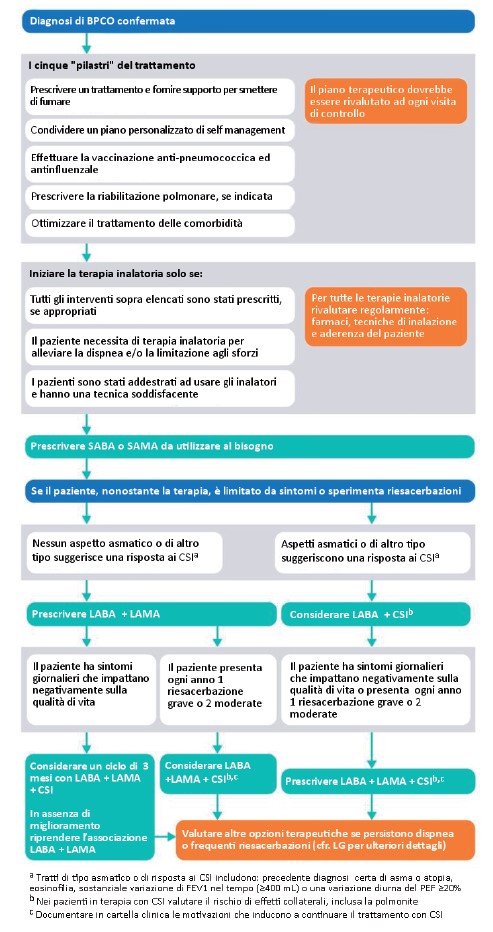
- Prescrivere dispositivi per farmaci inalatori solo dopo aver insegnato ai pazienti come utilizzarli ed essi abbiano dimostrato una soddisfacente tecnica inalatoria. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
- I pazienti con BPCO dovrebbero dimostrare una certa abilità nell’usare un dispositivo inalatorio ed essere regolarmente controllati, ed eventualmente corretti, da professionisti sanitari adeguatamente formati. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
- Usare broncodilatatori a breve durata di azione, al bisogno, come trattamento empirico iniziale per alleviare dispnea e limitazione agli sforzi. [Raccomandazione basata su evidenze di qualitĂ da bassa ad alta da trial randomizzati controllati]
Le terapie inalatorie a lunga durata di azione migliorano progressivamente i sintomi e riducono il rischio di riesacerbazioni. Prima di iniziare un farmaco a lunga durata di azione verificare se i 5 “pilastri” terapeutici sono stati messi in atto e se i pazienti sono ancora dispnoici nonostante l’impiego di un broncodilatatore a breve durata di azione. Inoltre, verificare se i sintomi quotidiani o gli episodi di riacutizzazione dei sintomi dipendono dalla BPCO e non da altre condizioni: ansia e depressione o, in particolare, alle frequenti comorbidità cardiovascolari causa di dispnea, spesso sotto-diagnosticate e sotto-trattate nei pazienti con BPCO (7,8).
Se, nonostante le raccomandazioni sopra descritte, i pazienti continuano ad essere dispnoici o sperimentano riesacerbazioni prescrivere farmaci antimuscarinici a lunga durata di azione (LAMA) insieme ad un ß2 agonista a lunga durata di azione (LABA), in assenza di aspetti asmatici o che suggeriscono una potenziale risposta terapeutica ai corticosteroidi. La combinazione di LAMA+LABA costituisce la terapia inalatoria più efficace. In monoterapia il LAMA è più efficace del LABA, ma alcuni modelli economici confermano che la strategia di prescrivere la combinazione LAMA+LABA è più efficace rispetto alla prescrizione di un solo farmaco aggiungendo successivamente l’altro. La LG raccomanda di ridurre al minimo sia il numero di farmaci inalatori, sia i dispositivi inalatori usati da ciascun paziente.
Ai pazienti con diagnosi di asma e BPCO dovrebbero essere prescritti corticosteroidi inalatori (CSI) insieme ad un’appropriata terapia antiasmatica, secondo la LG NICE per l’asma (9).
La LG riconosce sia la difficoltà di distinguere in alcuni pazienti l’asma dalla BPCO, sia il fatto che questi pazienti sono quasi sempre esclusi dai trial clinici sulla terapia inalatoria nella BPCO.
Di seguito vengono definiti gli aspetti (asmatici e non) che suggeriscono la responsivitĂ agli steroidi:
- diagnosi pregressa e certa di asma o atopia
- elevata conta di eosinofili
- sostanziale variazione graduale del FEV1 (≥400 mL), oppure
- sostanziale variazione diurna del picco di flusso espiratorio (≥20%).
La definizione di “elevata” conta di eosinofili è una scelta terminologica deliberata, in quanto non può essere definita una soglia specifica per due ragioni. Innanzitutto, nonostante le evidenze suggeriscano una correlazione tra conta degli eosinofili e risposta agli steroidi, non è ancora chiaro qual è la soglia esatta o in quali occasioni o per quanto tempo il valore dovrebbe rimanere elevato. In secondo luogo, il termine “elevato” riflette il fatto che la soglia probabilmente è nel range di valore normale per gli eosinofili, ma nella fascia più alta.
Se sono presenti aspetti (asmatici e non) che suggeriscono una risposta agli steroidi, considerare un LABA/CSI per via inalatoria, piuttosto che un LAMA/LABA come terapia inalatoria iniziale a lungo termine.
Prima di iniziare LAMA+LABA+CSI, effettuare una rivalutazione clinica come sopra discusso.
- Ai pazienti con BPCO in terapia con LABA+CSI, prescrivere LAMA+LABA+CSI se:
- hanno sintomi quotidiani che peggiorano la qualitĂ di vita, oppure
- presentano una riesacerbazione severa da richiedere il ricovero ospedaliero, oppure
- presentano due riesacerbazioni moderate in un anno
- Ai pazienti con BPCO in terapia con LAMA+LABA, considerare LAMA+LABA+CSI se:
- presentano una riesacerbazione severa da richiedere il ricovero ospedaliero, oppure
- presentano due riesacerbazioni moderate in un anno
- Nei pazienti con BPCO in terapia con LAMA+LABA con sintomi quotidiani che riducono la qualitĂ di vita:
- considerare un ciclo di LAMA+LABA+CSI per 3 mesi
- dopo 3 mesi rivalutare l’eventuale miglioramento della sintomatologia a seguito del trattamento LAMA+LABA+CSI:
- in caso di mancato miglioramento sospendere LAMA+LABA+CSI e riprendere il trattamento combinato LAMA+LABA
- in caso di miglioramento continuare con la triplice associazione LAMA+LABA+CSI [Raccomandazione basata su evidenze di qualità da molto bassa ad elevata da trial randomizzati controllati, modelli di economia sanitaria e l’esperienza e l’opinione del GDG]
- documentare in cartella clinica le motivazioni per continuare i CSI e rivalutare il paziente almeno una volta l’anno [Raccomandazione basata sull’esperienza e l’opinione del GDG]
- essere consapevoli e discutere con il paziente in terapia con CSI i possibili effetti collaterali, inclusa la polmonite. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
7. Profilassi antibiotica in pazienti con frequenti riesacerbazioni
Una terapia antibiotica regolare dovrebbe essere presa in considerazione soltanto nei pazienti con elevato numero di riesacerbazioni nei quali può essere efficace.
- Prima di iniziare una profilassi antibiotica in un paziente con BPCO considerare la necessità di un supporto specialistico respiratorio. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
- Prima di iniziare una profilassi antibiotica assicurarsi che il paziente abbia:
- eseguito un esame colturale con antibiogramma (incluso quello per la tubercolosi), per identificare altre possibili cause di infezione persistente o ricorrente per le quali possa essere appropriata una terapia specifica (es. patogeni antibiotico-resistenti, micobatteri atipici, Pseudomonas aeruginosa)
- ricevuto istruzioni sulle modalità per ottimizzare l’eliminazione di espettorato
- eseguito una TAC toracica per escludere la presenza di bronchiectasie ed altre patologie polmonari.
- Considerare una profilassi con azitromicina (250 mg tre volte alla settimana) per i pazienti con BPCO non fumatori (visto che è inefficace in quelli che fumano ancora) che hanno abbondanti espettorazioni quotidiane e continuano a presentare:
- frequenti riesacerbazioni (≥4/anno) con espettorazione
- prolungate riesacerbazioni con espettorazione
- riesacerbazioni che richiedono un ricovero ospedaliero
- Prima di iniziare l’azitromicina assicurarsi che il paziente abbia eseguito
- elettrocardiogramma per escludere la presenza di un intervallo QT allungato
- test di funzionalitĂ epatica
- Nel prescrivere l’azitromicina informare i pazienti sul minimo rischio di perdita di udito e tinnito consigliando di rivolgersi ad uno specialista se dovessero presentarsi questi sintomi. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
Nei pazienti con BPCO non esistono studi a lungo termine sulla profilassi antibiotica che potrebbe avere rischi e benefici ancora non noti. Medici e pazienti con BPCO dovrebbero tenere in considerazione i programmi di stewardship antibiotica e il rischio di aumentare l’antibiotico-resistenza. La terapia dovrebbe essere rivalutata inizialmente dopo 3 mesi, quindi almeno ogni 6 mesi e proseguita solo se i benefici sono superiori ai rischi.
- Per i pazienti in profilassi con azitromicina a rischio di riesacerbazioni prescrivere un antibiotico non-macrolide da tenere a casa come parte del piano di azione per la gestione delle riesacerbazioni. [Raccomandazione basata sull’esperienza e l’opinione del GDG]
La profilassi con azitromicina può essere continuata anche quando è necessario aggiungere un secondo antibiotico per il trattamento di una riesacerbazione acuta.
8. Riduzione chirurgica del volume polmonare
In pazienti con BPCO ed enfisema polmonare adeguatamente selezionati, la riduzione chirurgica del volume polmonare — lung volume reduction (LVR) — può migliorarne la dispnea, a capacitĂ di esercizio fisico e la sopravvivenza (5). Le evidenze supportano l’impiego di valvole endobronchiali in pazienti con BPCO con fessure interlobari intatte documentate dalla TAC polmonare (9,10) (box 5). Nuove raccomandazioni forniscono informazioni su quando indirizzare i pazienti con BPCO alla chirurgia toracica per un trapianto polmonare, ma è importante che non siano presenti fragilitĂ o comorbiditĂ che potrebbero compromettere i risultati del trapianto.
|
Box 5. Criteri per considerare la riduzione del volume polmonare Dopo un percorso di riabilitazione, le condizioni cliniche di un paziente con BPCO dovrebbero essere ottimizzate. Nel corso dei controlli successivi: 1.Prendere in considerazione una riduzione del volume polmonare in presenza dei seguenti criteri:
2. In presenza dei criteri di cui al punto 1, effettuare un nuovo controllo pneumologico per valutare:
3. In presenza dei criteri di cui al punto 2, inviare il paziente ad un team specializzato nella riduzione dei volumi polmonari per valutarne la fattibilitĂ |
9. Ossigenoterapia
L’ossigenoterapia a lungo termine può migliorare la sopravvivenza dei pazienti BPCO con ipossiemia (PaO2 <7.3 kPa or <8 kPa in presenza di ipertensione polmonare/cuore polmonare o policitemia), ma non è efficace per la dispnea nei pazienti con BPCO non ipossiemici. Ai pazienti fumatori con ipossiemia prescrivere un completo programma terapeutico e di supporto per smettere di fumare come punto chiave del trattamento della BPCO.
- Non prescrivere ossigenoterapia a lungo termine ai pazienti che continuano a fumare nonostante la proposta di un programma per smettere di fumare e la terapia di supporto, per il rischio di incendio ed alle sue conseguenze sia per i pazienti che per gli altri. Inviare questi pazienti ad un centro antifumo. [Raccomandazione basata su evidenze di qualitĂ moderata derivate da trial randomizzati controllati]
- Non prescrivere ossigenoterapia per trattare la dispnea nei pazienti con BPCO con ipossiemia a riposo lieve o assente. [Raccomandazione basata su evidenze di qualitĂ elevata da trial randomizzati controllati]
- Considerare l’ossigenoterapia per la deambulazione di pazienti con desaturazione durante l’esercizio fisico che dimostrano un miglioramento della capacità di esercizio con l’ossigeno e sono motivati all’ossigenoterapia. [Raccomandazione basata su evidenze di qualità elevata da trial randomizzati controllati]
10. Potenziali ostacoli all’implementazione
Le raccomandazioni di questa LG richiedono, da parte di tutti i team clinico-assistenziali, sia nell’ambito delle cure primarie che secondarie, un’erogazione completa del trattamento e del supporto per smettere di fumare. Per tutti i pazienti con dispnea inoltre è indispensabile l’accesso ad un programma di riabilitazione e la vaccinazione antinfluenzale, visto che il numero di pazienti con BPCO non vaccinati è ancora molto elevato.
La diagnosi accurata di BPCO richiede una spirometria completa con certificazione di qualità . Le visite di controllo dovrebbero sempre prevedere rilevazione e valutazione di comorbidità importanti che nella BPCO rappresentano la regola piuttosto che un’eccezione7. Un controllo attivo sulla terapia inalatoria è sempre necessario e in particolare dovrebbero essere sempre disponibili le motivazioni per l’assunzione di steroidi inalatori.
Nel Regno Unito il ricorso alle procedure di riduzione del volume polmonare è limitato e rappresenta un bisogno non soddisfatto. Il percorso di riabilitazione polmonare dovrà necessariamente includere una valutazione successiva dei pazienti che al termine del programma sono ancora dispnoici per identificare quelli da sottoporre alla riduzione del volume polmonare.
11. Raccomandazioni per la ricerca futura
- Nei pazienti con BPCO un programma di riabilitazione polmonare precoce (durante il ricovero ospedaliero per riesacerbazione o entro 1 mese), rispetto ad un programma tardivo (dopo 1 mese) migliora la qualitĂ di vita, riduce il numero dei successivi ricoveri ospedalieri e le riesacerbazioni e la costo-efficacia?
- Come i fattori prognostici individuali della BPCO (derivati da fonti quali cure primarie, radiologia, servizi di riabilitazione polmonare) possono essere confrontati in un’analisi multidimensionale per ottenere informazioni utili ed accurate sulla prognosi?
- Qual è l’efficacia e la costo-efficacia delle terapie inalatorie (broncodilatatori e/o CSI) nei pazienti con BPCO stabile e asma?
- Nei pazienti con BPCO quali sono gli aspetti predittivi piĂą accurati della risposta ai CSI?
- Quali sottogruppi di pazienti con BPCO stabile ad elevato rischio di riesacerbazione hanno maggiori probabilitĂ di trarre beneficio dalla profilassi antibiotica?



